Pentafluorure d'uranium
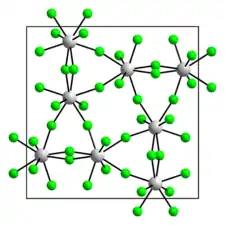
Le pentafluorure d'uranium, ou fluorure d'uranium(V), est un composé chimique de formule UF5. Il se présente sous la forme d'un solide jaune pâle cristallisé dans le système tétragonal selon le groupe d'espace I42d (no 122) avec comme paramètres cristallins a = 1 150 pm et c = 519,8 pm[3]. Ce polymorphe, dit β, est stable aux températures inférieures à 130 °C[5], température à laquelle survient une transition de phase vers le polymorphe α, également tétragonal mais de groupe d'espace I4/m (no 87) et de paramètres cristallins a = 651,2 pm et c = 446,3 pm[3].
| Pentafluorure d'uranium | |
| |
| __ U5+ __ F− Structure cristalline du fluorure d'uranium(V) β |
|
| Identification | |
|---|---|
| Nom UICPA | pentafluorouranium |
| Synonymes |
fluorure d'uranium(V) |
| No CAS | |
| No ECHA | 100.033.991 |
| No CE | 237-405-9 |
| PubChem | 83723 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | UF5 |
| Masse molaire[1] | 333,020 93 ± 3,0E−5 g/mol F 28,52 %, U 71,48 %, |
| Propriétés physiques | |
| T° fusion | 348 °C[2] |
| Masse volumique | α : 5,81 g/cm3[2] β : 6,45 g/cm3[3] |
| Cristallographie | |
| Système cristallin | tétragonal |
| Classe cristalline ou groupe d’espace | α : I4/m (no 87) [3] β : I42d (no 122) [3] |
| Paramètres de maille | a = 1 150 pm (β), c = 519,9 pm (β)[3] |
| Précautions | |
 Composé radioactif |
|
| SGH[4] | |
   Danger |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Production
Le pentafluorure d'uranium peut être obtenu en faisant réagir du pentachlorure d'uranium UCl5 ou de l'hexachlorure d'uranium (en) UCl6 avec du fluorure d'hydrogène HF anhydre[3] :
D'autres réactions sont possibles, comme la médiamutation du tétrafluorure d'uranium UF4 et de l'hexafluorure d'uranium UF6 ou la fluoration directe du tétrafluorure au fluor F2[3] :
La réduction de l'hexafluorure par le monoxyde de carbone CO à haute température avec libération de fluorure de carbonyle COF2 est également possible[6] :
Il est également possible de réduire l'hexafluorure d'uranium en pentafluorure sous l'action de bromure d'hydrogène HBr[3] ou de dioxyde de soufre SO2 à 160 °C[7].
Propriétés et applications
Le pentafluorure d'uranium peut être sublimé au-dessus de 500 °C, avec dismutation commençant à 150 °C[3]. Il forme des cristaux bleu pâle et fond sous pression d'UF6 à 348 °C. La substance se compose d'unités UF5 et forme des chaînes linéaires à l'aide de ponts fluor[8]. Le monomère a une géométrie fluctuante entre D3h et C4v[9].
Le pentafluorure d'uranium étant associé à l'hexafluorure UF6, il intervient dans l'enrichissement de l'uranium en isotope fissile 235U par séparation isotopique par laser sur vapeur atomique, procédé dans lequel une molécule de 235UF6 est excitée sélectivement par un premier laser accordé pour permettre à un second laser de séparer un atome de fluor en formant le pentafluorure 235UF5, qui précipite et peut donc facilement être filtré hors du gaz ; le 238UF6 n'est pas clivé et reste donc dans le gaz, ce qui permet d'en extraire sélectivement l'uranium 235 en y laissant l'uranium 238. Ce procédé conceptuellement élégant s'avère cependant assez difficile à mettre en œuvre à l'échelle industrielle.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, 89e éd., CRC Press, 2008, p. 3-17. (ISBN 978-1420066791)
- (de) Georg Brauer, en collaboration avec Marianne Baudler, Handbuch der Präparativen Anorganischen Chemie, 3e éd. révisée, vol. 2, Ferdinand Enke, Stuttgart, 1978, p. 1203-1204. (ISBN 3-432-87813-3)
- Entrée « Uranium compounds » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 1 janvier 2022 (JavaScript nécessaire)
- (en) J. C. Taylor et A. B. Waugh, « Neutron diffraction study of β-uranium pentafluoride between 77 and 403 K », Journal of Solid State Chemistry, vol. 35, no 2, , p. 137-140 (DOI 10.1016/0022-4596(80)90485-5, Bibcode 1980JSSCh..35..137T, lire en ligne)
- (en) Gordon W. Halstead, P. Gary Eller et Robert T. Paine, « 35. Uranium(V) Fluorides and Alkoxides », Inorganic Syntheses, vol. 21, (DOI 10.1002/9780470132524.ch35, lire en ligne)
- (en) P. Gary Eller, A. C. Larson, J. R. Peterson, D. D. Ensor et J. P. Young, « Crystal structures of α-UF5 and U2F9 and spectral characterizationof U2F9 », Inorganica Chimica Acta, vol. 37, , p. 129-133 (DOI 10.1016/S0020-1693(00)95530-0, lire en ligne)
- (en) C. J. Howard, J. C. Taylor et A. B. Waugh, « Crystallographic parameters in α-UF5 and U2F9 by multiphase refinement of high-resolution neutron powder data », Journal of Solid State Chemistry, vol. 45, no 3, , p. 396-398 (DOI 10.1016/0022-4596(82)90185-2, lire en ligne)
- (en) J. Onoe, H. Nakamatsu, T. Mukoyama, R. Sekine, H. Adachi et K. Takeuchi, « Structure and Bond Nature of the UF5 Monomer », Inorganic Chemistry, vol. 36, no 9, , p. 1934-1938 (DOI 10.1021/ic961237s, lire en ligne)



