Méthode de la goutte sessile
La méthode de la goutte sessile est une méthode utilisée pour la caractérisation des densités surfaciques d'énergie solides et, dans certains cas, des aspects des tensions superficielles des liquides.
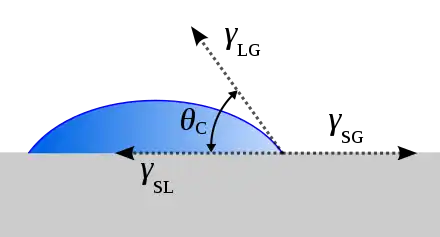

La prémisse principale de la méthode est qu'en plaçant une goutte de liquide avec une énergie surfacique connue, la forme de la goutte, spécifiquement l'angle de contact, et l'énergie surfacique connue du liquide sont les paramètres qui peuvent être utilisés pour calculer l'énergie surfacique de l'échantillon solide. Le liquide utilisé pour de telles expériences est appelé liquide de référence, et l'utilisation de plusieurs liquides de référence différents est nécessaire.
Introduction à la tension superficielle
La tension superficielle (énergie de surface) est une force qui existe au niveau de toute interface entre deux milieux différents (entre un solide ou un liquide et un gaz). La tension entre des milieux identiques : deux solides, deux liquides, ou également entre un liquide et un solide est généralement appelée: la tension interfaciale.
C'est donc cette force, la tension superficielle, qui permet à la goutte d'eau de ne pas s'étaler sur une feuille, ou à certains insectes de marcher sur l'eau, ou bien encore qui permet cette forme bombée de l'eau dans un verre à ras bord avec la notion de capillarité.
La nature d’une surface est liée aux propriétés chimiques des molécules présentes à la surface et peu (ou pas) du substrat sous-jacent. Une surface n’est que rarement de la même nature que le constituant présent « dans la masse ». La présence d’un film d’oxyde sur les métaux comme l’aluminium, de molécules d’eau adsorbées, ou de contaminants organiques comme des huiles, des tensioactifs (film lessiviel), des polymères (revêtement) etc. sont significatives.
Au niveau des interfaces, la discontinuité des forces moléculaires qui règnent au sein des matériaux implique l’existence d’une énergie de surface, aussi appelée tension de surface. Elle est donnée en newtons par mètre (N/m) ou en joules par mètre carré (J/m2) : c’est l’énergie nécessaire en joules pour accroître la surface de l’interface d'un mètre carré, ou la force nécessaire en newtons pour accroître le diamètre de l'interface d'un mètre. Cela est directement relié à la cohésion des molécules entre-elles.
Liquide de référence
La densité surfacique d'énergie est mesurée en joules par surface, ce qui est équivalent dans le cas des liquides à la tension superficielle, mesurée newtons par mètre. La tension superficielle globale d'un liquide peut être acquise par diverses méthodes en utilisant un tensiomètre ou en utilisant la méthode de la goutte pendante (en) et la méthode de la pression maximale des bulles (en).
La tension superficielle à l'interface du liquide de référence et de la surface solide peut en outre être considérée comme le résultat de différents types de forces intermoléculaires. En tant que telles, les énergies de surface peuvent être subdivisées en fonction des interactions qui les provoquent, telles que l'énergie de surface due aux forces dispersives (van der Waals, liaisons hydrogène, interactions polaires, réaction acido-basique, etc.). Pour la technique de la goutte sessile, il est préférable d'utiliser des liquides dont on sait qu'ils sont incapables de certaines de ces interactions (voir le tableau 1). Par exemple, la tension de surface de tous les alcanes linéaires est entièrement dispersive et toutes les autres composantes sont nulles. Ceci est algébriquement utile, car il élimine une variable dans certains cas, et fait de ces liquides des éléments essentiels de test.
L'énergie totale de surface, pour un solide comme un liquide, est en général supposée égale à la somme des composantes étudiées. Par exemple, l'équation décrivant la subdivision des énergies de surface dans les composantes correspondant aux interactions dispersives et les interactions polaires est comme suit :
Dans cette expression, est la densité surfacique d'énergie totale du solide, et sont respectivement ses composantes dispersive et polaire ; est la tension superficielle totale du liquide, et ainsi que sont respectivement ses composantes dispersive et polaire.
En plus du tensiomètre et la technique de la goutte pendante, la méthode de goutte sessile peut être utilisée dans certains cas pour séparer la tension superficielle totale d'un liquide en ses composantes. C'est effectué en inversant l'idée ci-dessus avec l'introduction d'une surface solide de référence supposée incapable d'interactions polaires, comme le Polytétrafluoroéthylène (PTFE)[1].
Angle de contact
L'angle de contact est défini comme l'angle formé par l'intersection de l'interface liquide/solide et de l'interface liquide/air. Il peut être décrit alternativement comme l'angle entre la surface de l'échantillon solide et la tangente de la forme ovale de la goutte au bord de la goutte. Lorsqu’une goutte d’un liquide assez petite, donc négligeant les forces de gravité, est déposée sur une surface, elle prend la forme d’une calotte sphérique. L’angle au bord de la goutte θ (point triple) est appelé angle de contact ou angle de raccordement. Un angle de contact élevé indique une faible densité surfacique d'énergie solide ou une affinité chimique, ce qu'on appelle parfois un faible degré de mouillage. Un faible angle de contact indique une densité surfacique d'énergie solide ou une affinité chimique élevée et un degré de mouillage élevé ou parfois complet. Parfois, cet angle dépasse même 90° comme c’est le cas d’une goutte de mercure sur du verre ou de l’eau sur du Téflon. Dans le cas d’une forte affinité avec la surface, le liquide peut complètement s’étaler ; l’angle est alors de 0° et la surface est dite hydrophile : il y a mouillage complet.
Méthode du goniomètre
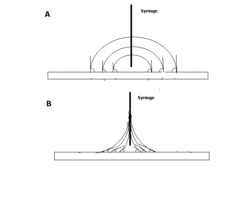
Le moyen le plus simple de mesurer l'angle de contact d'une goutte sessile est l'utilisation un goniomètre à angle de contact (en), qui permet à l'utilisateur de mesurer visuellement l'angle de contact. Une goutte est déposée par une seringue qui est positionnée au-dessus de la surface de l'échantillon, et une caméra haute résolution capture l'image à partir du profil ou de la vue de côté. L'image peut ensuite être soit analysée à l'œil nu (avec un rapporteur), soit mesurée à l'aide d'un logiciel d'analyse d'image. Ce type de mesure est appelé mesure d'angle de contact statique[2].
L'angle de contact est affecté non seulement par la chimie de surface mais aussi par la rugosité de surface. L'équation de Young, qui est à la base de l'angle de contact, suppose une surface homogène sans rugosité de surface. Dans le cas où la rugosité de surface est présente, la goutte peut être dans l'état de Wenzel (mouillage homogène), dans l'état de Cassie-Baxter (mouillage hétérogène) ou dans un état intermédiaire. La rugosité de surface amplifie le comportement de mouillage causé par la chimie de surface[3].
Afin de mesurer l'hystérésis de l'angle de contact, on peut augmenter progressivement le volume de la goutte sessile. L'angle de contact maximum possible est appelé angle de contact progressif. L'angle de contact de recul peut être mesuré en enlevant le volume de la goutte jusqu'à ce que le démouillage se produise. L'angle de contact minimum possible est appelé angle de contact récessif[2] L'hystérésis de l'angle de contact est la différence entre l'angle de contact progressif et de recul[2].
Avantages et inconvénients
L'avantage de cette méthode, mis à part sa nature relativement simple, est le fait qu'avec une surface solide suffisamment grande, plusieurs gouttes peuvent être déposées à divers endroits sur l'échantillon pour en déterminer l'hétérogénéité. La reproductibilité de valeurs particulières de l'angle de contact reflète l'hétérogénéité des propriétés énergétiques de la surface. Cependant, l'inconvénient est que si l'échantillon est seulement assez grand pour une goutte, il sera difficile d'en déterminer l'hétérogénéité, ou par conséquent de supposer l'homogénéité. Ceci est particulièrement vrai du fait que les goniomètres conventionnels, disponibles dans le commerce, ne pivotent pas la caméra/le rétroéclairage par rapport à la platine, et ne peuvent donc montrer que l'angle de contact en deux points: le bord droit et le bord gauche de la goutte. En plus de cela, cette mesure est gênée par sa subjectivité inhérente, puisque le placement des lignes est déterminé soit par l'utilisateur qui regarde les images, soit par la définition des lignes par le logiciel d'analyse d'image.
Méthode de Wilhelmy
Une méthode alternative pour mesurer l'angle de contact est la méthode de Wilhelmy, qui utilise un dynamomètre sensible pour mesurer une force qui peut être traduite en une valeur de l'angle de contact. Dans cette méthode, un petit échantillon en forme de plaque du solide en question, attaché au bras d'un mesureur de force, est plongé verticalement dans un liquide de référence (en réalité, la conception d'un compteur de force stationnaire relèverait le liquide au lieu de plonger l'échantillon), et la force exercée sur l'échantillon par le liquide est mesurée par le dynamomètre. Cette force est liée à l'angle de contact par l'équation suivante :
où F est la force totale mesurée par le dynamomètre, est la force de flottabilité due à l'échantillon solide qui déplace le liquide, est la longueur mouillée et est la tension superficielle du liquide, qui est connue.
Avantages et inconvénients
L'avantage de cette méthode est qu'elle est assez objective et que la mesure fournit des données qui sont moyennées par nature sur la longueur mouillée. Bien que cela n'aide pas à déterminer l'hétérogénéité, cela donne automatiquement une valeur moyenne plus précise. Ses inconvénients, en plus d'être plus compliqués que la méthode du goniomètre, comprennent le fait que l'échantillon d'une taille appropriée doit être produit avec une section transversale uniforme dans la direction d'immersion, et la longueur mouillée doit être mesurée avec une certaine précision. De plus, cette méthode n'est appropriée que si les deux côtés de l'échantillon sont identiques, sinon les données mesurées seront le résultat de deux interactions complètement différentes[4].
Strictement parlant, ce n'est pas une technique de goutte sessile, car nous utilisons un liquide dans un récipient plutôt qu'une goutte. Cependant, les calculs décrits dans les sections suivantes, qui ont été dérivés pour la relation de l'angle de contact de la goutte sessile avec l'énergie de surface, s'appliquent aussi bien.
Détermination de la densité surfacique d'énergie
Alors que la densité surfacique d'énergie est conventionnellement définie comme le travail requis pour construire une unité d'aire d'une surface donnée[5], quand il s'agit de sa mesure par la technique de la goutte sessile, l'énergie de surface n'est pas aussi bien définie. Les valeurs obtenues par la technique de la goutte sessile dépendent non seulement de l'échantillon solide en question, mais également des propriétés du liquide de référence utilisé, ainsi que de la théorie particulière qui lie mathématiquement les paramètres les uns aux autres.
Il existe de nombreuses théories développées par divers chercheurs. Ces méthodes diffèrent à plusieurs égards, telles que la dérivation et la convention, mais surtout elles diffèrent par le nombre de composantes ou de paramètres qu'elles sont équipées pour analyser. Les méthodes plus simples contenant moins de composantes simplifient le système en regroupant l'énergie de surface en un seul nombre, tandis que des méthodes plus rigoureuses avec plus de composantes sont dérivées pour distinguer les différentes composantes de l'énergie de surface. Là encore, l'énergie de surface totale des solides et des liquides dépend de différents types d'interactions moléculaires, telles que les interactions dispersives (van der Waals), polaires et acides / bases, et est considérée comme la somme de ces composants indépendants. Certaines théories expliquent plus de ces phénomènes que d'autres théories. Ces distinctions doivent être prises en compte lors du choix de la méthode appropriée pour l'expérience en cours. Voici quelques-unes de ces théories couramment utilisées.
La théorie de Zisman
La théorie de Zisman est la théorie la plus simple qui soit couramment utilisée, car elle est une théorie à une seule composante, et est utilisée pour les surfaces non polaires. Cela signifie que les surfaces de polymères qui ont subi un traitement thermique, un traitement corona (en), un nettoyage au plasma (en) ou des polymères contenant des hétéroatomes ne se prêtent pas à cette théorie particulière, car ils tendent à être au moins quelque peu polaires. La théorie de Zisman tend également à être plus utile dans la pratique pour les surfaces ayant des énergies plus basses.
La théorie de Zisman définit simplement la densité surfacique d'énergie comme étant égale à la tension de surface du liquide de tension de surface le plus élevé qui mouille complètement le solide. Cela veut dire que la goutte se dispersera autant que possible, c'est-à-dire qu'elle mouillera complètement la surface, pour ce liquide et tout liquide ayant des tensions de surface plus basses, mais pas pour les liquides ayant des tensions de surface plus élevées. Puisque ce liquide pourrait être n'importe quel liquide, y compris un liquide imaginaire, la meilleure façon de déterminer la densité surfacique d'énergie par la méthode de Zisman est d'acquérir des points d'angle de contact pour plusieurs liquides de référence sur la surface solide en question, puis tracer le cosinus de cet angle en fonction la tension de surface connue du liquide de référence. En construisant le diagramme de Zisman, on peut extrapoler la tension de surface liquide la plus élevée, réelle ou hypothétique, qui résulterait en un mouillage complet de l'échantillon avec un angle de contact de zéro degré.
Précision
Le coefficient directeur suggère que le résultat est assez précis, cependant c'est seulement le cas pour l'appariement de ce solide particulier avec ces liquides particuliers. Dans d'autres cas, l'ajustement peut ne pas être si bon (c'est le cas si nous remplaçons le polyéthylène par du poly(méthacrylate de méthyle), où le coefficient de ligne des résultats de tracé utilisant la même liste de liquides serait significativement plus faible). Cette lacune résulte du fait que la théorie de Zisman traite la densité surfacique d'énergie comme un seul paramètre, plutôt que de tenir compte du fait que, par exemple, les interactions polaires sont beaucoup plus fortes que les interactions dispersives, et donc le degré auquel on se produit par rapport à l'autre affecte grandement les calculs nécessaires. En tant que tel, c'est une théorie simple mais pas particulièrement robuste. Puisque la prémisse de cette procédure est de déterminer les propriétés hypothétiques d'un liquide, la précision du résultat dépend de la précision à laquelle les valeurs de tension de surface des liquides de référence sont connues.
La théorie Owens/Wendt
La théorie d'Owens/Wendt[6] (après C. J. van Oss et John F. Wendt) divise la densité surfacique d'énergie en deux composantes: la densité surfacique d'énergie due aux interactions dispersives et celle due aux interactions polaires. Cette théorie est dérivée de la relation d'Young (en), qui relie l'angle de contact à la densité surfacique d'énergie du solide, la tension de surface du liquide et à la tension d'interface, et l'équation de Good (nommée après RJ Good), qui relie la tension d'interface aux composantes polaire et dispersive de la densité surfacique d'énergie. L'équation principale qui en résulte est :
À noter que cette équation est de la forme , avec :
Ainsi, les composantes polaire et dispersive de la densité surfacique d'énergie du solide sont déterminées par la pente et l'ordonnée à l'origine du graphique résultant. Bien sûr, le problème à ce stade est que, pour faire ce graphique, connaître la tension de surface du liquide de référence n'est pas suffisant, car il est nécessaire de savoir précisément comment elle se décompose en ses composantes polaire et dispersive.
Pour ce faire, on peut simplement inverser la procédure en testant le liquide de référence contre un solide de référence standard qui n'est pas capable d'interactions polaires, comme le PTFE. Si l'angle de contact d'une goutte sessile du liquide de référence est mesuré sur une surface de PTFE avec:
l'équation principale se réduit comme suit:
Puisque la tension de surface totale du liquide est déjà connue, cette équation détermine la composante dispersive, et la différence entre les composantes totale et dispersive donne la composante polaire.
Précision
L'exactitude et la précision de cette méthode sont largement corroborées par le niveau de confiance des résultats pour les combinaisons liquide / solide appropriées. La théorie d'Owens/Wendt est généralement applicable aux surfaces de faible charge et de polarité modérée. Quelques bons exemples sont les polymères qui contiennent des hétéroatomes, tels que le PVC, les polyuréthanes, les polyamides, les polyesters, les polyacrylates (en) et les polycarbonates.
La théorie de Fowkes
La théorie de Fowkes (après F. M. Fowkes) est dérivée d'une manière légèrement différente de la théorie d'Owens/Wendt, bien que l'équation principale de la théorie de Fowkes soit mathématiquement équivalente à celle d'Owens et de Wendt:
À noter qu'en divisant les deux côtés de l'équation par , l'équation du principe d'Owens/Wendt est récupérée. Ainsi, l'une des options pour la bonne détermination des composants de la densité surfacique d'énergie est la même.
En plus de cette méthode, il est également possible de faire simplement des tests en utilisant des liquides sans composante polaire à leur tension de surface, puis des liquides qui ont des composantes polaire et dispersive, puis linéariser les équations (voir tableau 1). Tout d'abord, on effectue la mesure de l'angle de contact de la goutte sessile standard pour le solide en question et un liquide avec une composante polaire nulle (; ). La deuxième étape consiste à utiliser un second liquide de référence qui possède à la fois une composante dispersive et une composante polaire à sa tension de surface, puis de résoudre les inconnues algébriquement. La théorie de Fowkes exige généralement l'utilisation de seulement deux liquides de référence, comme décrit ci-dessus, et les recommandés sont le diiodométhane, qui ne devrait avoir aucune composante polaire en raison de sa symétrie moléculaire, et l'eau connu pour être un liquide très polaire.
Précision
Bien que l'équation principale soit essentiellement identique à celle d'Owens et de Wendt, la théorie de Fowkes dans un sens plus large a des applications légèrement différentes. Parce qu'elle est dérivée de principes différents de ceux d'Owens/Wendt, le reste de l'information qui concerne la théorie de Fowkes est liée à l'adhésion. En tant que tel, elle est plus applicable aux situations où l'adhésion se produit, et fonctionne généralement mieux que la théorie Owens/Wendt lorsqu'il s'agit de tensions de surface plus élevées[1].
En outre, il existe une théorie de Fowkes étendue, fondée sur les mêmes principes, mais divisant la tension de surface totale en une somme de trois plutôt que deux composantes: tension de surface due aux interactions dispersives, interactions polaires et liaisons hydrogène.
La théorie de Wu
La théorie de Wu (après Souheng Wu) est aussi essentiellement similaire aux théories d'Owens / Wendt et de Fowkes, en ce qu'elle divise l'énergie de surface en une composante polaire et une composante dispersive. La différence principale est que Wu utilise les moyennes harmoniques plutôt que les moyennes géométriques des tensions de surface connues, et par conséquent des mathématiques plus rigoureuses sont employées.
Précision
La théorie de Wu fournit des résultats plus précis que les deux autres théories, en particulier pour les énergies de surface élevées. Elle souffre cependant d'une complication: à cause des mathématiques impliquées, la théorie de Wu donne deux résultats pour chaque composante, l'un étant le vrai résultat et l'autre étant simplement une conséquence des mathématiques. Le défi à ce stade consiste à interpréter quel est le vrai résultat. Parfois, cela est aussi simple que d'éliminer le résultat qui n'a pas de sens physique (une énergie de surface négative) ou le résultat qui est clairement incorrect en raison d'être de plusieurs ordres de grandeur plus grand ou plus petit qu'il devrait l'être. Parfois, l'interprétation est plus difficile.
La théorie de Schultz
La théorie de Schultz (après D. L. Schultz) est applicable uniquement pour les solides à très haute énergie. Encore, elle est semblable aux théories d'Owens, de Wendt, de Fowkes, et de Wu, mais est conçue pour les situations où la mesure conventionnelle exigée pour ces théories est impossible. Dans la classe des solides ayant une énergie de surface suffisamment élevée, la plupart des liquides mouillent complètement la surface avec un angle de contact de zéro degré, et donc aucune donnée utile ne peut être recueillie. La théorie et la procédure Schultz appellent à déposer une goutte sessile de liquide de référence sur la surface solide en question, tandis que le système est submergé dans un autre liquide, plutôt que d'être fait à l'air libre. En conséquence, la pression atmosphérique plus élevée due au liquide environnant provoque la compression de la goutte de liquide de référence de sorte qu'il existe un angle de contact mesurable.
Précision
Cette méthode est conçue pour être robuste là où les autres méthodes ne fournissent même pas de résultats en particulier. En tant que tel, elle est indispensable, car c'est la seule façon d'utiliser la technique de la goutte sessile sur des solides à très haute densité surfacique d'énergie. Son inconvénient majeur est le fait qu'elle soit beaucoup plus complexe, à la fois dans ses mathématiques et expérimentalement. La théorie de Schultz exige que l'on tienne compte de beaucoup plus de facteurs, car il y a maintenant l'interaction inhabituelle de la phase liquide de référence avec la phase liquide environnante. De plus, l'installation de la caméra et du rétro-éclairage devient plus compliquée en raison des propriétés de réfraction du liquide environnant, sans parler de la mise en place du système à deux liquides lui-même.
La théorie de van Oss
La théorie de van Oss[7] sépare l'énergie de surface des solides et des liquides en trois composants. Elle inclut l'énergie de surface dispersive, comme précédemment, et subdivise la composante polaire comme étant la somme de deux composantes plus spécifiques: l'énergie de surface due aux interactions acides () et celle due aux interactions basiques (). La composante acide décrit théoriquement la propension d'une surface à avoir des interactions polaires avec une seconde surface qui a la capacité d'agir comme une base en donnant des électrons. Inversement, la composante basique de l'énergie de surface décrit la propension d'une surface à avoir des interactions polaires avec une autre surface qui agit comme un acide en acceptant les électrons. L'équation principale pour cette théorie est:
Encore une fois, la meilleure façon de traiter cette théorie, tout comme les théories à deux composantes, est d'utiliser au moins trois liquides (plus peut être utilisé pour obtenir plus de résultats à des fins statistiques) - un avec seulement une composante dispersive à sa tension superficielle (), une avec seulement un composant dispersif et un composant acide ou basique (), et enfin un liquide avec un composant dispersif et un composant basique ou acide (la composante que le second liquide de référence n'avait pas ()), ou un liquide avec les trois composants () - et linéariser les résultats.
Précision
Étant une théorie à trois composantes, elle est naturellement plus robuste que les autres théories, en particulier dans les cas où il existe un grand déséquilibre entre les composantes acide et basique de l'énergie de surface polaire. La théorie van Oss est la plus appropriée pour tester les énergies de surface des composés inorganiques, organométalliques et des surfaces contenant des ions.
La difficulté la plus importante de l'application de la théorie de van Oss est le fait qu'il n'y a pas beaucoup d'accord en ce qui concerne un ensemble de solides de référence qui peuvent être utilisés pour caractériser les composantes acides et basiques des liquides de référence potentiels. Il y a cependant certains liquides qui sont généralement reconnus comme ayant des composantes dispersive/acide/basique connus pour leurs énergies de surface. Deux d'entre eux sont répertoriés dans le tableau 1.
Liste de liquides de référence courants
Le tableau 1 liste quelques liquides de référence courants à 20 °C.
| Liquide | Tension superficielle totale (mJ/m2) |
Composante dispersive (mJ/m2) |
Composante polaire (mJ/m2) |
Composante acide (mJ/m2) |
Composante basique (mJ/m2) |
|---|---|---|---|---|---|
| Formamide [8] | 58,0 | 39,0 | 19,0 | 2,28 | 39,6 |
| Diiodométhane | 50,8 | 50,8 | 0 | 0 | 0 |
| Eau | 72,8 | 26,4 | 46,4 | 23,2 | 23,2 |
Problèmes potentiels
La présence d'éléments tensioactifs tels que l'oxygène et le soufre aura un impact important sur les mesures obtenues avec cette technique. Les éléments tensioactifs existeront en plus grandes concentrations à la surface que dans la masse du liquide, ce qui signifie que les niveaux totaux de ces éléments doivent être soigneusement contrôlés à un niveau très bas. Par exemple, la présence de seulement 50 ppm de soufre dans le fer liquide réduira la tension superficielle d'environ 20 %[9].
Applications pratiques
La technique de la goutte sessile a diverses applications pour la science des matériaux et la caractérisation directe. En général, elle est utile pour déterminer la tension superficielle des liquides en utilisant des solides de référence. Il y a diverses autres applications spécifiques qui peuvent être subdivisées en fonction de laquelle des théories ci-dessus est la plus susceptible d'être applicable aux circonstances :
La théorie de Zisman est principalement utilisée pour les énergies de surface faibles et ne caractérise que la densité surfacique d'énergie. En tant que tel, elle est probablement plus utile dans les cas qui rappellent la définition conventionnelle des surfaces, par exemple si un ingénieur chimiste veut savoir quelle est l'énergie associée à la fabrication d'une surface. Il peut également être utile dans les cas où l'énergie de surface a un effet sur une technique spectroscopique utilisée sur le solide en question.
Les théories des deux composantes s'appliquent très probablement aux questions d'ingénierie des matériaux concernant les interactions pratiques des liquides et des solides. La théorie de Fowkes, mieux adaptée aux surfaces solides à énergie plus élevée, et dont une bonne partie s'inspire des théories sur l'adhésion, conviendrait probablement pour la caractérisation des interactions où les solides et les liquides ont une forte affinité pour un autre, comme, assez logiquement, les adhésifs et l'enduction adhésive. La théorie d'Owens/Wendt, qui traite des surfaces solides à faible énergie, sert à caractériser les interactions où les solides et les liquides n'ont pas une forte affinité l'un pour l'autre - par exemple, l'efficacité de l'imperméabilisation. Les polyuréthanes et le PVC sont de bons exemples de plastiques imperméables.
La théorie de Schultz est la mieux utilisée pour la caractérisation de surfaces à très haute énergie pour lesquelles les autres théories sont inefficaces, l'exemple le plus significatif étant les métaux nus.
La théorie de van Oss est la plus appropriée pour les cas dans lesquels l'interaction acide/base est une considération importante. On a par exemple les pigments, les produits pharmaceutiques et le papier. Plus précisément, des exemples notables comprennent à la fois le papier utilisé pour l'impression régulière et le cas plus spécialisé du papier de tournesol, qui est lui-même utilisé pour caractériser le pH.
Voir aussi
Notes et références
- Christopher Rullison, So You Want to Measure Surface Energy?, Kruss Laboratories technical memo.
- Carl. Clegg, Contact Angle Made Easy, ramé-hart, , 4–10,40-47
- « Influence of surface roughness on contact angle and wettability »
- Christopher Rullison, A Practical Comparison of Techniques Used to Measure Contact Angles for Liquids on Non-Porous Solids, Kruss Laboratories technical, note 303.
- K. Oura, V. G. Lifshits, A. A. Saranin, A. V. Zotov, M. Katayama, Surface Science: An Introduction, Springer-Verlag, Berlin, 2001, p. 233
- D. K. Owens et R. C. Wendt, « Estimation of the surface free energy of polymers », J. Apply. Polym. Sci, vol. 13, no 8, , p. 1741-1747
- Robert J. Good et Carel J. van Oss, Modern approaches to wettability, Springer, , 1-27 p., « The modern theory of contact angles and the hydrogen bond components of surface energies »
- (en) Jianying Shanga, Markus Fluryab, James B. Harsha et Richard L. Zollars, « Comparison of different methods to measure contact angles of soil colloids », Journal of Colloid and Interface Science, vol. 328, no 2, , p. 299–307 (DOI 10.1016/j.jcis.2008.09.039, lire en ligne)
- Seshadri Seetharaman, Fundamentals of metallurgy, Woodhead Publishing in Materials, Cambridge, 2005.































![{\displaystyle \sigma _{L}(\cos \theta +1)=2\left[{\sqrt {\sigma _{L}^{D}\sigma _{S}^{D}}}+{\sqrt {\sigma _{L}^{-}\sigma _{S}^{+}}}+{\sqrt {\sigma _{L}^{+}\sigma _{S}^{-}}}\right]}](https://img.franco.wiki/i/1cc09370bab976bfe2908c2a9aacf30284a66400.svg)


