Enzyme de clivage de la chaîne latérale du cholestérol
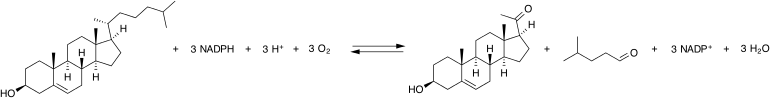
L'enzyme de clivage de la chaîne latérale du cholestérol, souvent appelée de sa désignation anglaise cholesterol side-chain cleavage enzyme ou P450scc (où « scc » signifie « side chain cleaving ») et plus rarement par son appellation officielle cholestérol monooxygénase ou cholesterol desmolase ou encore par le nom de son gène CYP11A1, est une oxydoréductase qui catalyse la séquence de réactions suivante :
- cholestérol + 2 adrénodoxines réduites + O2 22R-hydroxycholestérol + 2 adrénodoxines oxydées + H2O ;
- 22R-hydroxycholestérol + 2 adrénodoxines réduites + O2 20α,22R-dihydroxycholestérol + 2 adrénodoxines oxydées + H2O ;
- 20α,22R-dihydroxycholestérol + 2 adrénodoxines réduites + O2 prégnénolone + 4-méthylpentanal + 2 adrénodoxines oxydées + 2 H2O.
(clivant la chaîne latérale)
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
L'adrénodoxine étant chaque fois réduite par l'un des deux électrons du NADPH sous l'action de l'adrénodoxine réductase, la réaction globale peut être représentée comme ci-dessous :
Localisation de la P450scc
L'enzyme de clivage de la chaîne latérale du cholestérol fait partie de la superfamille des cytochromes P450. On la trouve de préférence dans le cortex surrénal, le corps jaune et les cellules de la thèque interne dans l'ovaire, ainsi que les cellules de leydig dans le testicule[2]. Le placenta sécrète également une certaine quantité de ce système enzymatique au cours de la grossesse[3]. Elle est présente en quantités moindres dans divers autres tissus tels que le cerveau[4]. La concentration d'adrénodoxine est du même niveau que celle de la P450scc dans le cortex surrénalien, mais l'adrénodoxine réductase y est moins exprimée[5].
Les études par immunofluorescence à l'aide d'anticorps dirigés contre les protéines du système enzymatique P450scc ont montré que ces dernières sont situées exclusivement dans les mitochondries[6] - [7]. Elles sont situées sur la membrane mitochondriale interne du côté de la matrice mitochondriale[8]. L'adrénodoxine et l'adrénodoxine réductase sont des protéines solubles de la matrice mitochondriale situées au voisinage de la membrane mitochondriale interne qui semblent s'associer avant tout par interactions électrostatiques[9].
Mécanisme d'action
La P450scc catalyse la conversion du cholestérol en prégnénolone en trois réactions successives de type monooxygénase : les deux premières consistent en une hydroxylation de la chaîne latérale du cholestérol successivement en 22R-hydroxycholestérol et en 20α,22R-dihydroxycholestérol, tandis que la troisième conduit au clivage de la liaison entre les atomes de carbone no 20 et 22, libérant la prégnénolone et le 4-méthylpentanal (4-méthylvaléraldéhyde).
Chaque réaction de type monooxygénase requiert deux électrons fournis par du NADPH[10] à travers l'adrénodoxine réductase[11] au moyen de l'adrénodoxine[12] - [13]. Ces trois protéines — adrénodoxine réductase, adrénodoxine et P450scc — constituent le complexe de clivage de la chaîne latérale du cholestérol. Ce complexe n'existe cependant pas sous forme de trois protéines liées ensemble car les analyses aussi bien spectroscopiques que cinétiques convergent pour mettre en évidence le fait que l'adrénodoxine réductase et la P450scc entrent en compétition pour se lier à l'adrénodoxine, cette dernière fonctionnant donc comme une navette à électron entre la réductase et la P450scc[12]. Ceci a par ailleurs été confirmé par l'étude structurale de ces protéines[1].
Le transfert des électrons du NADPH à la P450scc n'est pas complètement couplé par l'adrénodoxine, ce qui signifie qu'une partie des électrons de l'adrénorédoxine réduite réagit avec O2 en générant des ions superoxyde O2.-[14]. Les cellules impliquées dans la biosynthèse des stéroïdes possèdent un ensemble de systèmes antioxydants destinés à juguler l'effet de radicaux produites par ces enzymes[15].
Notes et références
- (en) Natallia Strushkevich, Farrell MacKenzie, Tatyana Cherkesova, Irina Grabovec, Sergey Usanov et Hee-Won Park, « Structural basis for pregnenolone biosynthesis by the mitochondrial monooxygenase system », Proceedings of the National Academy of Sciences of the United States of America, vol. 108, no 25, , p. 10139-10143 (PMID 21636783, PMCID 3121847, DOI 10.1073/pnas.1019441108, lire en ligne)
- (en) Israel Hanukoglu, « Steroidogenic enzymes: Structure, function, and role in regulation of steroid hormone biosynthesis », The Journal of Steroid Biochemistry and Molecular Biology, vol. 43, no 8, , p. 779-804 (PMID 22217824, DOI 10.1016/0960-0760(92)90307-5, lire en ligne)
- (en) J. F. Strauss, F. Martinez et M. Kiriakidou, « Placental steroid hormone synthesis: unique features and unanswered questions », Biology of Reproduction, vol. 54, no 2, , p. 303-311 (PMID 8788180, DOI 10.1095/biolreprod54.2.303, lire en ligne)
- (en) B. Otto, U. Cuntz, E. Fruehauf, R. Wawarta, C. Folwaczny, R. L. Riepl, M. L. Heiman, P. Lehnert, M. Fichter et M. Tschop, « Weight gain decreases elevated plasma ghrelin concentrations of patients with anorexia nervosa », Clinical and Translational Endocrinology from around the Globe, vol. 145, , p. 669-673 (PMID 11720889, DOI 10.1530/eje.0.1450669, lire en ligne)
- (en) Israel Hanukoglu et Zelda Hanukoglu, « Stoichiometry of mitochondrial cytochromes P-450, adrenodoxin and adrenodoxin reductase in adrenal cortex and corpus luteum », European Journal of Biochemistry, vol. 157, no 1, , p. 27-31 (PMID 3011431, DOI 10.1111/j.1432-1033.1986.tb09633.x, lire en ligne)
- (en) I. Hanukoglu, B. S. Suh, S. Himmelhoch et A. Amsterdam, « Induction and mitochondrial localization of cytochrome P450scc system enzymes in normal and transformed ovarian granulosa cells », Journal of Cell Biology, vol. 111, no 4, , p. 1373-1381 (PMID 2170421, PMCID 2116250, DOI 10.1083/jcb.111.4.1373, lire en ligne)
- (en) I. Hanukoglu, R. Feuchtwanger et A. Hanukoglu, « Mechanism of corticotropin and cAMP induction of mitochondrial cytochrome P450 system enzymes in adrenal cortex cells », Journal of Biological Chemistry, vol. 265, no 33, , p. 20602-20608 (PMID 2173715, lire en ligne)
- (en) Yigal Farkash, Rina Timberg et Joseph Orly, « Preparation of Antiserum to Rat Cytochrome P-450 Cholesterol Side Chain Cleavage, and Its Use for Ultrastructural Localization of the Immunoreactive Enzyme by Protein A-Gold Technique », Endocrinology, vol. 118, no 4, , p. 1353-1365 (PMID 3948785, DOI 10.1210/endo-118-4-1353, lire en ligne)
- (en) Israel Hanukoglu, Christopher T. Privalle et Colin R. Jefcoate, « Mechanisms of Ionic Activation of Adrenal Mitochondrial Cytochromes P-450scc and P-45011β », Journal of Biological Chemistry, vol. 256, no 9, , p. 4329-4335 (PMID 6783659, lire en ligne)
- (en) Israel Hanukoglu et Revital Rapoport, « Routes and regulation of NADPH production in steroidogenic mitochondria », Endocrine Research, vol. 21, nos 1-2, , p. 231-241 (PMID 7588385, DOI 10.3109/07435809509030439, lire en ligne)
- (en) Israel Hanukoglu, Tamar Gutfinger, Mitsuru Haniu et John E. Shively, « Isolation of a cDNA for adrenodoxin reductase (ferredoxin –NADP+ reductase) », European Journal of Biochemistry, vol. 169, no 3, , p. 449-455 (PMID 3691502, DOI 10.1111/j.1432-1033.1987.tb13632.x, lire en ligne)
- (en) I. Hanukoglu et C. R. Jefcoate, « Mitochondrial cytochrome P-450scc Mechanism of electron transport by adrenodoxin », Journal of Biological Chemistry, vol. 255, no 7, , p. 3057-3061 (PMID 6766943, lire en ligne)
- (en) Israel Hanukoglu, Vitaly Spitsberg, John A. Bumpus, Karl M. Dus et Colin R. Jefcoate, « Adrenal Mitochondrial Cytochrome P-450scc », Journal of Biological Chemistry, vol. 256, no 9, , p. 4321-4328 (PMID 7217084, lire en ligne)
- (en) I. Hanukoglu, R. Rapoport, L. Weiner et D. Sklan, « Electron Leakage from the Mitochondrial NADPH-Adrenodoxin Reductase-Adrenodoxin-P450scc (Cholesterol Side Chain Cleavage) System », Archives of Biochemistry and Biophysics, vol. 305, no 2, , p. 489-498 (PMID 8396893, DOI 10.1006/abbi.1993.1452, lire en ligne)
- (en) Israel Hanukoglu, « Antioxidant Protective Mechanisms against Reactive Oxygen Species (ROS) Generated by Mitochondrial P450 Systems in Steroidogenic Cells », Drug Metabolism Reviews, vol. 38, nos 1-2, , p. 171-196 (PMID 16684656, DOI 10.1080/03602530600570040, lire en ligne)
