Disulfure de molybdène
Le disulfure de molybdène, ou sulfure de molybdène(IV), est un composé chimique de formule MoS2. Il s'agit d'un solide noir cristallisé diamagnétique et semiconducteur, semblable au graphite par son apparence et son toucher, et de ce fait utilisé comme lubrifiant mécanique, parfois à température élevée. Sa forme minérale est la molybdénite, principal minerai dont est extrait le molybdène.
| Disulfure de molybdène | |
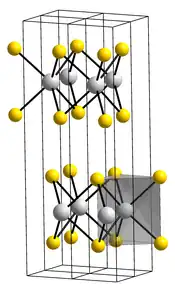 __ Mo4+ __ S2− Structure cristalline du disulfure de molybdène |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.013.877 |
| No CE | 215-263-9 |
| PubChem | 14823 |
| SMILES | |
| InChI | |
| Apparence | solide noir |
| Propriétés chimiques | |
| Formule | MoS2 [Isomères] |
| Masse molaire[1] | 160,09 ± 0,03 g/mol Mo 59,94 %, S 40,06 %, |
| Propriétés physiques | |
| T° fusion | 450 °C sublim. |
| Solubilité | pratiquement insoluble dans l'eau à 20 °C |
| Masse volumique | 5,06 g·cm-3[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
Structure
Dans le MoS2 cristallisé, chaque Mo4+ est lié à six ligands S2− occupant les sommets d'un prisme droit à base triangulaire au sein desquels la couche d'atomes de molybdène est prise en sandwich entre deux couches d'atomes de soufre[3]. Deux couches d'atomes de soufre adjacentes étant liées par des forces de van der Waals, elles présentent un faible coefficient de friction entre elles, à l'origine de leurs propriétés lubrifiantes.
La forme bidimensionnelle du disulfure de molybdène fait de lui une alternative prometteuse au graphène pour des applications en micro-électronique[4].
Propriétés chimiques
Le disulfure de molybdène est stable à l'air et à l'oxygène aux conditions normales, mais réagit à chaud avec O2 pour former du trioxyde de molybdène MoO3 :
Le chlore Cl2 attaque le disulfure de molybdène à haute température pour former du pentachlorure de molybdène MoCl5 :
Le disulfure de molybdène réagit aux conditions normales avec les organolithiens pour donner des composés d'intercalation LixMoS2. Avec le n-buthyllithium C4H9Li, il donne LiMoS2.
Applications
Comme lubrifiant solide
Le disulfure de molybdène sous forme de particules de 1 à 100 μm de diamètre est un lubrifiant solide couramment employé. Il existe peu d'alternatives ayant à la fois de bonnes propriétés lubrifiantes et une bonne stabilité thermique jusqu'à 350 °C en milieu oxydant. Les tests de friction réalisés à l'aide d'une pointe sur un disque donnent comme coefficient de frottement à faible charge (0,1 à 2 N) des valeurs inférieures à 0,1.
Le disulfure de molybdène entre souvent dans la composition de mélanges ou de matériaux composites dont les surfaces doivent présenter une friction faible. C'est par exemple le cas des matières plastiques, pour lesquels l'addition de MoS2 conduit à la formation de composites à la résistance et aux propriétés de friction améliorées. Le nylon, le polytétrafluoroéthylène et le Vespel (en) comptent parmi les polymères organiques susceptibles d'être chargés de MoS2. On utilise également des revêtements auto-lubrifiants appliqués par dépôt chimique en phase vapeur pour les applications à haute température.
Des lubrifiants à base de disulfure de molybdène sont utilisés par exemple avec les moteurs à deux temps, les freins à rétropédalage de bicyclette, les joints de transmission, les cardans et les balles d'armes à feu.
Comme catalyseur
Le disulfure de molybdène est utilisé comme cocatalyseur de désulfuration (hydrodésulfuration) en pétrochimie. Son efficacité comme catalyseur est accrue par dopage avec de petites quantités de cobalt et de nickel. L'alumine Al2O3 est fréquemment employée comme support de ces catalyseurs. Ces derniers sont produits in-situ en traitant de l'alumine imprégnée de molybdène et de cobalt ou de nickel avec du sulfure d'hydrogène H2S ou un réactif équivalent. La catalyse ne se déroule pas à la surface des régions cristallisées en feuillets réguliers, mais plutôt le long des bords de ces feuillets[5].
Le disulfure de molybdène est également utilisé comme catalyseur d'hydrogénation dans les synthèses organiques. Il est issu d'un métal de transition commun du 6e groupe, à la différence de nombreux autres catalyseurs équivalents, qui sont plutôt issus de métaux du 10e groupe, plus rares, de sorte que le MoS2 est retenu lorsque le prix du catalyseur ou sa résistance à l'empoisonnement au soufre sont des critères déterminants. Il est efficace pour l'hydrogénation de groupes nitro en groupes amine et peut être employé pour produire des amines secondaires par amination réductrice[6]. Il peut également catalyser l'hydrogénolyse de composés organosulfurés, d'aldéhydes, de cétones, de phénols et d'acides carboxyliques pour donner leur alcane correspondant ; il n'est cependant pas très actif, et a souvent besoin de pression d'hydrogène supérieure à 95 atm et des températures supérieures à 185 °C.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Molybdenum(IV) sulfide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 28 août 2011 (JavaScript nécessaire)
- (en) Wells, A.F., Structural Inorganic Chemistry, Oxford, Clarendon Press, , 5e éd., 1382 p. (ISBN 978-0-19-855370-0, LCCN 82018866)
- (en) David L. Chandler, « One-molecule-thick material has big advantages : Researchers produce complex circuits from molybdenum disulfide », sur phys.org, (consulté le ).
- (en) Henrik Topsøe, Bjerne S. Clausen et Franklin E. Massoth, « Hydrotreating Catalysis », Catalysis-Science and Technology, vol. 11, , p. 1-269 (DOI 10.1007/978-3-642-61040-0_1, lire en ligne)
- (en) Frederick S. Dovell et Harold Greenfield, « Base-Metal Sulfides as Reductive Alkylation Catalysts », The Journal of Organic Chemistry, vol. 29, no 5, , p. 1265-1267 (DOI 10.1021/jo01028a511, lire en ligne)