Dissection aortique
La dissection aortique est une affection rare et grave caractérisée par l'irruption de sang à l'intérieur de la paroi de l'aorte. Elle constitue une déchirure ou porte d'entrée, par laquelle le sang sous pression entre et décolle les feuillets superposés qui constituent la paroi élastique de l'aorte. La dissection de ces feuillets peut s'étendre sur une longue portion de l'aorte ascendante, la crosse aortique et/ou l'aorte descendante. Elle constitue une urgence chirurgicale.
| Spécialité | Chirurgie vasculaire |
|---|
| CIM-10 | I71.0 |
|---|---|
| CIM-9 | 441.0 |
| OMIM | 607086 |
| DiseasesDB | 805 |
| MedlinePlus | 000181 |
| eMedicine | 756835 |
| MeSH | D000784 |
| GeneReviews | |
| Patient UK | Aortic-dissection |
![]() Mise en garde médicale
Mise en garde médicale
On utilise parfois le terme d'anévrisme disséquant.

Épidémiologie
Son incidence annuelle est d'environ 3 cas pour 100 000 personnes[1]. Elle semble augmenter[2]. Le principal facteur de risque est l'hypertension artérielle, surtout si elle n'est pas équilibrée[3].
Deux tiers des dissections sont de type A (concernant l'aorte ascendante) et un tiers de type B (aorte descendante)[4]. Outre l'HTA, la dilatation de l'aorte ascendante est un facteur de risque important, surtout pour les dissections de type A[5].
La mortalité en est élevée puisque près de la moitié des patients décèdent à la phase aiguë (20 % avant l'arrivée à l'hôpital)[6].
Plusieurs maladies génétiques prédisposent au risque de survenue d'une dissection aortique : maladie de Marfan, syndrome d'Ehlers-Danlos, syndrome de Loeys-Dietz, ainsi qu'une bicuspidie aortique. En dehors de ces syndromes, il existe également des formes familiales[7].
Elle survient le plus souvent en hiver, surtout lors d'une chute de température[8].
Le risque est augmenté en cas de prise de fluoroquinolones, un antibiotique[9]. Des cas ont été rapportés chez des athlètes dopés aux stéroïdes anabolisants[10].
Mécanisme
_Victoria_blue-HE.jpg.webp)
Le terrain essentiel de la dissection est la présence d'une hypertension artérielle non stabilisée sous traitement. Elle peut survenir également chez des patients porteurs de maladie de la fibre élastique (contenues notamment dans l'aorte) comme la maladie de Marfan. La préexistence d'un anévrisme aortique est décrite dans un cinquième des cas[1].
La formation d'un hématome (collection de sang coagulé) de paroi aortique est une entité décrite depuis la fin des années 1990 et peut évoluer vers la dissection. Il n'est pas sûr que cela soit le seul mécanisme responsable mais la découverte d'une telle anomalie peut imposer un traitement chirurgical rapide.
La dissection débute par une « porte d'entrée », rupture de la paroi interne (intima) permettant le décollement de cette dernière en pleine media (partie moyenne de la paroi). Ce décollement s'étend le plus souvent d'amont en aval et forme une poche de sang circulant, le « faux chenal », séparé du « vrai chenal » (la lumière de l'artère) par un flap (constitué par la paroi décollée). Plus rarement, la progression se fait en rétrograde : d'aval en amont (un tiers des cas[11]). La porte d'entrée peut être multiple dans un quart des cas[12].
C'est une affection gravissime car elle peut progresser rapidement et provoquer en amont :
- une insuffisance de la valve aortique massive par basculement d'une cuspide de cette dernière, entraînant une insuffisance cardiaque grave ;
- la rupture dans le péricarde entraînant un épanchement péricardique sanguin abondant avec compression du cœur (tamponnade) pouvant évoluer vers une défaillance cardiaque et un arrêt cardiorespiratoire ;
- une dissection par extension des artères coronaires avec occlusion de ces dernières et constitution d'un infarctus du myocarde ;
en aval :
- une rupture de l'aorte avec hémorragie interne massive fatale ;
- une progression de la dissection sur les différentes artères avec occlusion de ces dernières (ou baisse importante de leur débit) donnant un tableau d'ischémie localisé (accident vasculaire cérébral s'il s'agit d'une artère à destinée encéphalique, infarctus rénal s'il s'agit d'une artère rénale…).
En pratique, les complications les plus graves sont celles concernant le cœur et n'arrivent que si la dissection concerne l'aorte ascendante. Cette dernière constitue donc une urgence chirurgicale absolue. Les dissections de l'aorte descendante doivent être dans un premier temps traitées médicalement (par médicaments) et la chirurgie se discute alors cas par cas.
Classification

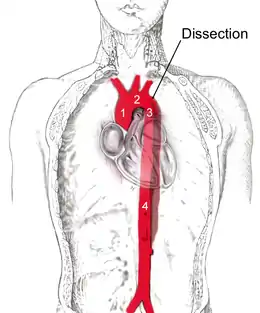
La classification de DeBakey est une classification anatomique des dissections de l'aorte en fonction de l'origine de la dissection et sur son extension vers l'aval (notamment l'extension de la dissection vers l'aorte ascendante, vers la crosse ou vers l'aorte descendante) :
- Type I - Débute à l'aorte ascendante, jusqu'à la crosse de l'aorte et la portion descendante (A sur le dessin) ;
- Type II – Débute et se localise uniquement à l'aorte ascendante (B sur le dessin) ;
- Type III – Débute et se localise à l'aorte descendante (C sur le dessin).
De manière pratique, la classification de Stanford distingue[13] :
- les dissections intéressant l'aorte ascendante (appelées « type A » et comprenant les types I et II de la classification de DeBakey), constituant une urgence chirurgicale et nécessitant le transfert rapide du patient vers un centre disposant d'une chirurgie cardiaque ;
- les dissections intéressant uniquement l'aorte descendante (appelées « type B » et correspondant au type III de la classification de DeBakey, dont le traitement reste essentiellement médicamenteux (baisse de la pression artérielle) même si elle requiert, plus rarement, une chirurgie.
Diagnostic
Le diagnostic a longtemps reposé sur l'angiographie. Cependant, cette méthode a été supplantée par l'avènement de l'échographie transœsophagienne pouvant être faite au lit du patient (seulement si le patient est stable hémodynamiquement) et l'angioscanner. L'imagerie par résonance magnétique permet également d'en faire le diagnostic.
Le diagnostic, bien qu'urgent en raison de la nécessité d'une prise en charge rapide, n'est parfois pas évident devant un tableau atypique et il peut être retardé jusque dans 40 % des cas[14].
Clinique
La dissection aortique est une affection brutale dominée par la douleur thoracique. Cette dernière se caractérise par son caractère migrateur (sa position varie dans le temps). La douleur peut être absente dans un cas sur 10[15].
On recherche systématiquement un terrain favorisant : hypertension artérielle, syndrome de Marfan (se caractérisant principalement par une grande taille, avec de long bras et doigts, une déformation du thorax, parfois enfoncé, une souplesse articulaire importante témoignant d'une hyperlaxité des ligaments).
L'examen clinique recherche :
- une abolition d'un ou plusieurs pouls, pouvant témoigner de l'extension de la dissection sur une artère périphérique ;
- un souffle à l'auscultation cardiaque, témoin d'une insuffisance de la valve aortique par atteinte de ses cuspides ;
- une pression artérielle différente aux deux bras (asymétrie tensionnelle de 20mmHg à la systole[16]) témoignant de la dissection de l'origine de l'une des artères à destination des membres supérieurs ;
- des signes de mauvaise tolérance (collapsus cardiovasculaire, voire arrêt cardiorespiratoire).
Suivant le niveau et l'extension de la dissection, le patient peut présenter des signes :
- d'un infarctus du myocarde par atteinte d'une artère coronaire ;
- d'un accident vasculaire cérébral par atteinte d'une carotide ou d'une artère vertébrale ;
- d'une ischémie aiguë du membre inférieur par atteinte d'une artère fémorale ;
- d'une tamponnade par compression du cœur par un épanchement de sang dans le péricarde.
La rupture de l'aorte entraîne un décès rapide et ne pose donc guère de problème diagnostique.
Dès la suspicion de dissection, le patient doit être admis rapidement, et de manière médicalisée, dans un centre pouvant confirmer le diagnostic avant un éventuel transfert en chirurgie cardiaque.
Examens complémentaires
Plusieurs examens permettent le diagnostic. Le choix de l'un ou l'autre dépend essentiellement de la disponibilité des appareils et du médecin l'effectuant en urgences.
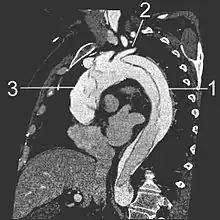
- Le scanner thoracique avec injection de produit de contraste dans le système vasculaire montre un double contraste de l'aorte qui est « coupée » en deux par le « flap ». Il permet de bien en délimiter l'extension. C'est l'examen à réaliser en première intention.
- L'échographie transœsophagienne consiste à faire avaler au patient, sous anesthésie locale, une sonde d'échographie fixé à un endoscope. L'examen permet de bien visualiser la quasi intégralité de l'aorte thoracique. En cas de dissection, le « flap » est clairement objectivé, ainsi que, parfois, la porte d'entrée et/ou de sortie. L'insuffisance de la valve aortique et son mécanisme peuvent être, également, facilement évalués. L'extension de la dissection vers l'aorte abdominale ne peut être analysée par cette technique, mais cette donnée reste secondaire dans la conduite à tenir (cf. classification des dissections).
- La radiographie du thorax montre une modification de la silhouette de l'aorte (élargissement du médiastin), qui est cependant inconstante, surtout si la dissection n'intéresse que l'aorte ascendante[17].
- L'électrocardiogramme (ECG) est de réalisation systématique devant toute douleur thoracique. Il peut montrer les signes d'une hypertrophie ventriculaire gauche secondaire à une hypertension non ou mal soignée. Il peut montrer également les signes d'un infarctus en cours de constitution ou des troubles de la repolarisation dans un quart des cas[18], pouvant faire évoquer, à tort, un diagnostic de syndrome coronarien aigu. Le plus souvent, l'ECG est normal.
L'échocardiographie "classique", dite transthoracique ne suffit pas à elle seule à éliminer le diagnostic de dissection, l'aorte thoracique étant une structure relativement profonde, mal visualisée par cette technique. Elle permet parfois de suspecter l'atteinte : dilatation de l'aorte ascendante ou horizontale, fuite aortique, parfois visualisation du flap intimal, épanchement péricardique...
De même, l'artériographie avec injection de produit de contraste intravasculaire est une technique abandonnée de nos jours, car la montée d'une sonde dans une artère disséquée peut aggraver la dissection.
Dans tous les cas, on effectue un bilan biologique préopératoire :
- ionogramme sanguin avec dosage de la créatinine pour évaluer la fonction rénale ;
- numération formule sanguine ;
- recherche d'une anomalie de la coagulation par la mesure du temps de céphaline activée et du taux de prothrombine ;
- recherche du groupe sanguin et du groupe Rhésus, recherche d'agglutinines irrégulières pour une éventuelle transfusion ;
- dosage des D-dimères sanguins (produits de dégradation de la fibrine), en règle générale, à un taux élevé, au point qu'un dosage normal permet d'éliminer le diagnostic de dissection[19].
Forme clinique : l'hématome de paroi
Appelé également « hématome intramural », il consiste en une collection de sang dans la paroi aortique, sans « flap » visible. Il évolue dans plus d'un quart des cas vers une dissection classique[20]. Il est situé essentiellement au niveau de l'aorte descendante[5].
Cliniquement, il n' y a habituellement pas d'asymétrie de la pression artérielle entre les deux bras et pas de signe d'ischémie.
Il est diagnostiqué lors d'un scanner ou lors d'une échographie transœsophagienne.
Sa prise en charge est calquée sur celle de la dissection classique : chirurgie urgente s'il concerne l'aorte thoracique ascendante, traitement médicamenteux s'il concerne l'aorte descendante.
Traitement
La prise en charge des dissections aortiques a fait l'objet de la publication de recommandations. Celles, américaines, datent de 2022[21]. Celles de l' European Society of Cardiology datent de 2014[22].
Malgré une prise en charge adaptée, la mortalité hospitalière reste élevée, atteignant 30 % dans les formes graves[23]. Elle s’accroît particulièrement avec l'âge avec une mortalité opératoire atteignant 40 % chez l'octogénaire[24].
Historique du traitement
La première intervention, décrite en 1935, consistait à effectuer une brèche (fenestration) dans la paroi du faux chenal, permettant ainsi une issue de secours pour le sang vers le vrai chenal et diminuant la pression dans le faux chenal[25]. À la fin des années 1940, on tentait de renforcer l'aorte disséquée en la doublant d'un tissu de cellophane[26].
Ce n'est qu'en 1955 que le Dr DeBakey décrit l'intervention qui a toujours lieu, consistant en la pose d'une prothèse dans l'aorte ascendante[27].
L'intérêt d'une baisse de la pression artérielle n'a été décrit que tardivement (milieu des années 1960)[28].
Traitement médical
Une hospitalisation urgente en milieu spécialisé est nécessaire.
Dans tous les cas, le traitement médical vise à faire baisser au maximum la pression artérielle et de manière rapide, avec un traitement intraveineux. Doit être associé un traitement antalgique.
Sauf complications, il s'agit du traitement de référence d'une dissection uniquement localisée au niveau de l'aorte descendante, une prise en charge chirurgicale systématique ayant un taux important de complication[29]. À distance, l'évolution se fait souvent vers la dilatation du vaisseau aboutissant à un anévrisme pouvant requérir une chirurgie.
Traitement chirurgical
En cas de dissection de l'aorte thoracique ascendante, le traitement est une urgence chirurgicale. Cela nécessite le transfert dans un centre de chirurgie cardiaque, la mise en place d'une circulation extracorporelle étant nécessaire. L'intervention consiste, après ouverture verticale du sternum, en la mise en place d'un tube dans l'aorte ascendante avec fermeture des portes d'entrée et de sortie. Suivant l'extension, le geste peut être associé à un remplacement de la valve aortique ou à une simple remise en place des cusps aortiques, à une réimplantation des artères coronaires ou des autres vaisseaux dans le tube.
En cas de dissection isolée de l'aorte abdominale, le traitement est essentiellement médicamenteux pour assurer un contrôle de la pression artérielle optimal. L'évolution n'en est pas pour autant bénigne, avec un risque de décès augmenté[30].
Traitement par cathétérisme
La mise en place d'une endo-prothèse (ou stent, « endo » signifiant que la prothèse est située à l'intérieur du vaisseau, ne remplaçant donc pas ce dernier) au cours d'un simple cathétérisme (par voie fémorale, et donc, sans chirurgie ni circulation extracorporelle) est une technique alternative de traitement des anévrismes de l'aorte.
Cette méthode a été utilisée également au cours de dissections aortiques, le stent permettant l'écrasement du faux chenal et facilitant ainsi son occlusion, soit par simple effet mécanique, soit par fermeture d'une porte d'entrée. Cette technique reste encore en cours d'évaluation[31].
Divers
L'acteur John Ritter (connu pour son rôle dans la sitcom Touche pas à mes filles) est décédé d'une dissection aortique, en 2003[32].
La seiyū (actrice de doublage) Hiromi Tsuru (connue pour son rôle de Bulma dans Dragon Ball) est décédée d'une dissection aortique, en 2017.
Le mangaka japonais Kentarō Miura (connu pour son manga Berserk) est décédé d'une dissection aortique aiguë le 6 mai 2021[33].
Andrew Fletcher, dit Fletch, cofondateur et membre du groupe Depeche Mode, est décédé le d'une dissection aortique[34].
L'avocat pénaliste Hervé Témime est décédé d'une dissection aortique le 10 avril 2023.
Notes et références
- (en) Golledge J, Eagle KA, « Acute aortic dissection » Lancet, 2008;372:55-66
- (en) Olsson C, Thelin S, Stahle E, Ekbom A, Granath F, « Thoracic aortic aneurysm and dissection: increasing prevalence and improved outcomes reported in a nationwide population-based study of more than 14,000 cases from 1987 to 2002 » Circulation 2006;14:2611–2618
- (en) Howard DP, Banerjee A, Fairhead JF et al. « Population-based study of incidence and outcome of acute aortic dissection and premorbid risk factor control: 10-year results from the Oxford Vascular Study » Circulation 2013;127:2031-7
- Evangelista A, Isselbacher EM, Bossone E et al. Insights from the international registry of acute aortic dissection: a 20-year experience of collaborative clinical research, Circulation, 2018;137:1846-1860
- Carrel T, Sundt TM 3rd, von Kodolitsch Y, Czerny M, Acute aortic dissection, Lancet, 2023:401;773-788
- (en) Olsson C, Thelin S, Stahle E, Ekbom A, Granath F, « Thoracic aortic aneurysm and dissection: increasing prevalence and improved outcomes reported in a nationwide population-based study of more than 14000 cases from 1987 to 2002 » Circulation 2006;114:2611-2618
- Chen SW, Kuo CF, Huang YT et al. Association of family history with incidence and outcomes of aortic dissection, J Am Coll Cardiol, 2020;76:1181-1192
- Chen J, Gao Y, Jiang Y et al. Low ambient temperature and temperature drop between neighbouring days and acute aortic dissection: a case-crossover study, Eur Heart J, 2022;43:228–235
- Vouga Ribeiro N, Gouveia Melo R, Guerra NC et al. Fluoroquinolones are associated with increased risk of aortic aneurysm or dissection: systematic review and meta-analysis, Semin Thorac Cardiovasc Surg, 2021;33:907-918
- Heydari A, Asadmobini A, Sabzi F, Anabolic steroid use and aortic dissection in athletes: a case series, Oman Med J, 2020;35:e179
- (en) Lansman SL, McCullough JN, Nguyen KH et al. Subtypes of acute aortic dissection, Ann Thorac Surg, 1999;67:1975–1978
- (en) Van Arsdell GS, David TE, Butany J, Autopsies in acute type A aortic dissection: surgical implications, Circulation, 1998;98 Suppl:II299–II302
- (en) Dr Yair Glick◉ and Dr Donna D'Souza◉ et al., « Stanford classification of aortic dissection », sur radiopaedia.org, (consulté le )
- (en) Olin JW, Fuster V, Acute aortic dissection: the need for rapid, accurate, and readily available diagnostic strategies, Arterioscler Thromb Vasc Biol, 2003;23:1721–1723
- (en) Hagan PG, Nienaber CA, Isselbacher EM, et al. The International Registry of Acute Aortic Dissection (IRAD): new insights into an old disease, JAMA, 2000;283:897-903
- Collège de médecine cardiovasculaire, issy les moulineaux, Elsevier Masson, , 611 p. (ISBN 978-2-294-77686-1), P 117
- von Kodolitsch Y, Nienaber CA, Dieckmann C et al. Chest radiography for the diagnosis of acute aortic syndrome, Am J Med, 2004;116:73-77
- (en) Biagini E, Lofegio C, Ferlito M et al. Frequency, determinants and clinical relevance of acute coronary syndrome-like electrocardiographic changes in patients with acute aortic syndrome, Am J Cardiol, 2007;100:1013–1019
- (en) Toru Suzuki, Distante A, Zizza A et al. Diagnosis of acute aortic dissection by D-Dimer: The International Registry of Acute Aortic Dissection Substudy on Biomarkers (IRAD-Bio) Experience, Circulation, 2009;119:2702-2707
- (en) von Kodolitsch Y, Csösz SK, Koschyk DH et al. Intramural hematoma of the aorta: predictors of progression to dissection and rupture, Circulation, 2003;107:1158–63
- Isselbacher EM, Preventza O, Hamilton Black J 3rd et al. 2022 ACC/AHA Guideline for the Diagnosis and Management of Aortic Disease: A Report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines, Circulation, 2022;146:e334-e482.
- Erbel R, Aboyans V, Boileau C et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases : Document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adultThe Task Force for the Diagnosis and Treatment of Aortic Diseases of the European Society of Cardiology (ESC), Eur Heart J, 20014;35:2873-2926
- (en) Trimarchi S, Nienaber CA, Rampoldi V et al. Contemporary results of surgery in acute type A aortic dissection: the International Registry of Acute Aortic Dissection experience, J Thorac Cardiovasc Surg, 2005;129:112–122
- (en) Trimarchi S, Eagle KA, Nienaber CA et al. Role of age in acute type A aortic dissection outcome: report from the International Registry of Acute Aortic Dissection (IRAD), J Thorac Cardiovasc Surg, 2010;140:784–789
- (en) Gurin D, Bulmer JW, Derby R, Dissecting aneurysms of the aorta: diagnosis and operative relief of arterial obstruction due to this cause, N Y State J Med, 1935;35:1200
- (en) Abbott OA, Clinical experiences with application of polythene cellophane upon aneurysms of thoracic vessels, J Thorac Surg, 1949;18:435
- (en) DeBakey ME, Cooley DA, Creech O Jr, Surgical considerations of dissecting aneurysm of the aorta, Ann Surg, 1955;142:586–610
- (en) Wheat MW Jr, Palmer RF, Bartley TD, Seelman RC, Treatment of dissecting aneurysms of the aorta without surgery, J Thorac Cardiovasc Surg. 1965;50:364–373
- (en) Coady MA, Ikonomidis JS, Cheung AT, Surgical management of descending thoracic aortic disease: Open and endovascular approaches, a scientific statement from the American Heart Association, Circulation, 2010;121:2780-2804
- (en) Thomas T. Tsai, Rossella Fattori, Santi Trimarchi, Eric Isselbacher, Truls Myrmel, Arturo Evangelista, Stuart Hutchison, Udo Sechtem, Jeanna V. Cooper, Dean E. Smith, Linda Pape, James Froehlich, Arun Raghupathy, James L. Januzzi, MD; Kim A. Eagle, Christoph A. Nienaber, Long-term survival in patients presenting with type B acute aortic dissection , Circulation, 2006;114:2226-31.
- (en) Swee W, Dake MD, Endovascular management of thoracic dissections, Circulation, 2008;117:1460-73.
- « The John Ritter Foundation » (consulté le )
- (ja) « 漫画家・三浦建太郎さんが死去 54歳 『ベルセルク』『ドゥルアンキ』など », sur www.oricon.co.jp, (consulté le ).
- (en) « Cause of death of Depeche Mode’s Andrew Fletcher revealed », sur the Guardian, (consulté le )
Voir aussi
Articles connexes
Liens externes
- Ressources relatives à la santé :
- GeneReviews
- ICD9Data.com
- (en) Diseases Ontology
- (en) DiseasesDB
- (en) Héritage mendélien chez l'humain
- (en) Héritage mendélien chez l'humain
- (en) ICD-10 Version:2016
- (en) Medical Subject Headings
- (en + es) MedlinePlus
- (en) NCI Thesaurus