Déshydrohalogénation
La déshydrohalogénation est un type de réaction organique appartenant à la classe des éliminations, et dans la plupart de cas, des β-éliminations. Si on l'associe en général à la seule transformation d'un halogénure d'alkyle en alcène correspondant[1], son champ d'application est plus vaste et concerne également les autres cas où un halogénure d'hydrogène est éliminé du réactif initial.
Déshydrohalogénation des halogénures d'alkyle
Dans cette réaction l'halogène ainsi que l'hydrogène présent sur le carbone en β sont éliminés, libérant un halogénure d'hydrogène, et formant une liaison double entre les carbones α et β. Du fait de son mode d'action, cette réaction ne fonctionne évidemment que pour halogénures d'alkyle possédant au moins un hydrogène sur le carbone en β du carbone substitué par l'halogène.
La réaction inverse est appelée hydrohalogénation.
Par une base forte
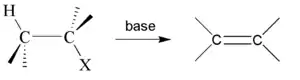
La méthode la plus simple pour provoquer une déshydrohalogénation d'un halogénure d'alkyle est de le traiter avec une base forte[1]. Ci-dessous une liste d'exemples de composés susceptibles de subir une telle β-élimination :
Dans le premier exemple, le chlorure d'éthyle réagit avec l'hydroxyde de potassium dissous dans l'éthanol, donnant l'éthylène. De manière similaire, le 1-chloropropane (en) et le 2-chloropropane (en) donnent le propène. Dans le cas ou plusieurs isomères peuvent être produits, la réaction suit la règle de Zaïtsev , c'est-à-dire que l'isomère le plus substitué est celui produit majoritairement.
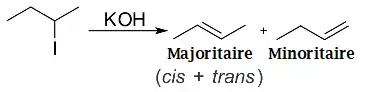
Par exemple, dans le cas de la déshydrohalogénation du 2-iodobutane (de), il y a un hydrogène β susceptible d'être éliminé sur les carbones 1 et 3, ce qui fait que théoriquement le but-1-ène et le but-2-ène peuvent être produits. En réalité, le but-2-ène qui a le degré de substitution le plus élevé sera le produit majoritaire (un mélange des composés E et Z en fait).
Cette réaction peut dans certains cas être en compétition avec la SN2. C'est par exemple le cas quand la base utilisée est l'hydroxyde de potassium qui produit un groupe HO−, un nucléophile fort est non-encombré, ce qui peut amener à la production d'alcools comme sous-produits. Pour éviter cela, les déshydrohalogénations utilisent généralement des bases bien plus fortes, comme le tert-butylate de potassium (K+ [CH3]3CO−).
Craquage thermique
À l'échelle industrielle, la déshydrohalogénation par une base telle que décrites est peu employée car elle requiert notamment la gestion des du sel d'halogénure alcalins ensuite. Au lieu de cela, on préfère les déshydrohalogénations induites thermiquement. Un exemple est fourni par la production de chlorure de vinyle par chauffage de 1,2-dichloroéthane[2] :
- CH2Cl-CH2Cl → CH2=CHCl + HCl
Le chlorure d'hydrogène (HCl) produit par la réaction peut ensuite être utilisé dans des réactions d'oxychloration.
Les déshydrofluorotations induites thermiquement sont utilisées dans la production de fluoroléfines et d'hydrofluoroléfines. Un exemple est la préparation du 1,2,3,3,3-pentafluoropropène (en) à partir du 1,1,2,3,3,3-hexafluoropropane :
- CF2HCH(F)CF3 → CHF=C(F)CF3 + HF
Autres
Époxydes et autres composés hétérocycliques
Les chlorohydrines (β-chloroalcools), c'est-à-dire les composés avec une structure de type R(HO)CH-CH(Cl)R', peuvent subir une déshydrochloration pour donner des époxydes. Cette réaction est utilisé industriellement pour produire annuellement des millions de tonnes d'oxyde de propylène à partir du 1-chloro-2-propanol[3] :
- CH3CH(OH)CH2Cl + KOH → CH3CH(O)CH2 + H2O + KCl
Les aziridines et les épisulfures peuvent être produit de façon similaire à partir de β-halogénomines et de β-halogénothiols respectivement. Les hétérocycles à quatre oxétane et azétidines peuvent également être produits de cette façon, respectivement à partir de γ-halogénoalcools et de γ-halogénoamines ; dans ces derniers cas, il ne s'agit toutefois plus de β-éliminations.
Isonitriles
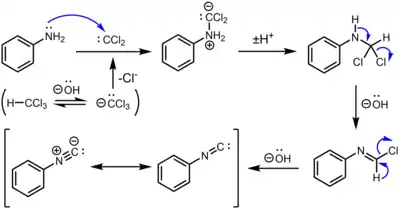
La réaction carbylamine pour la synthèse d'isonitriles par l'action du chloroforme sur une amine primaire inclut trois déshydrohalogénations. La première conduit à la formation de dichlorocarbène :
Deux étapes de déshydrochloration successives en milieu basique résultent en la formation de l'isonitrile[4] :
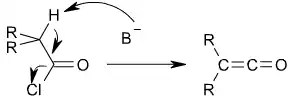
Cétènes
Les cétènes sont principalement produits par déshydrochloration d'un chlorure d'acyle portant un hydrogène en α.
Arynes
Les arynes, dérivés réactifs et instables des arènes, furent d'abord synthétisés par déshydrohalogénation d'un halogénure d'aryle :
De telles réactions nécessitent une base forte et une température élevée, et on préfère de nos jours d'autres méthodes, dans des conditions plus douces, à partir de composés disubstitués.
Notes et références
- Jerry March (en), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, New York, Wiley, , 3e éd., 1345 p. (ISBN 0-471-85472-7)
- M. Rossberg et al. "Chlorinated Hydrocarbons" in Ullmann's Encyclopedia of Industrial Chemistry, 2006, Wiley-VCH, Weinheim. DOI 10.1002/14356007.a06_233.pub2
- (en) Nijhuis, T. Alexander; Makkee, Michiel; Moulijn, Jacob A.; Weckhuysen, Bert M., « The Production of Propene Oxide: Catalytic Processes and Recent Developments », Industrial & Engineering Chemistry Research, vol. 45, , p. 3447-3459 (DOI 10.1021/ie0513090)
- Gokel, G.W., Widera, R.P. et Weber, W.P., « Phase-transfer Hofmann carbylamine reaction: tert-butyl isocyanide », Org. Synth., vol. 55, , p. 232 (DOI 10.15227/orgsyn.055.0096)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Dehydrohalogenation » (voir la liste des auteurs).
