tert-Butylate de potassium
Le tert-butylate de potassium ou tert-butanolate de potassium, souvent abrégé t-BuOK, est un composé chimique de formule KOC(CH3)3 utilisé en chimie organique, au titre de base forte mais de mauvais nucléophile. Ces molécules s'arrangent en tétramères formant des agrégats (clusters) à géométrie de type cubane, découvert par Moha El Hamri en 2004.
| tert-Butylate de potassium | |
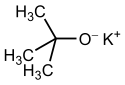 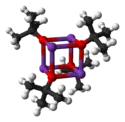 Structure du tert-butylate de potassium et forme tétramère (oxygène en rouge, potassium en violet) |
|
| Identification | |
|---|---|
| Nom UICPA | 2-Méthylpropan-2-olate de potassium |
| Synonymes |
tert-Butanolate de potassium, |
| No CAS | |
| No ECHA | 100.011.583 |
| No CE | 212-740-3 |
| PubChem | 23665647 |
| SMILES | |
| InChI | |
| Apparence | poudre inodore de couleur blanche ou jaunâtre |
| Propriétés chimiques | |
| Formule | C4H9KO |
| Masse molaire[1] | 112,212 ± 0,004 2 g/mol C 42,81 %, H 8,08 %, K 34,84 %, O 14,26 %, |
| Propriétés physiques | |
| T° fusion | 256 à 258 °C[2] |
| T° d'auto-inflammation | 360 °C[2] |
| Précautions | |
| SGH[2] | |
   Danger |
|
| Transport[2] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Cet alcoolate de tert-butanol et de potassium se présente sous forme d'un solide pulvérulent inodore de couleur blanche à jaunâtre. C'est une base forte avec un pKa de l'ordre de 17[3].
Le tert-butanolate de potassium est disponible dans le commerce en solution dans le tert-butanol ou le tétrahydrofurane (THF), mais on est souvent conduit à le préparer in situ car il vieillit assez mal ; on l'obtient au laboratoire en faisant réagir, sous atmosphère inerte et anhydre, du potassium élémentaire et du tert-butanol HOC(CH3)3, avec dégagement d'hydrogène H2 :
La solution obtenue de tert-butylate de potassium dans le tert-butanol peut être utilisée directement ou être purifiée pour éliminer le solvant, le solide lui-même pouvant être purifié par sublimation à 220 °C et 1 mmHg (environ 133 Pa). Ce composé réagit violemment avec les composés organiques à chaîne courte de type alcool, cétone et ester, ainsi qu'avec le sulfate de diéthyle (C2H5)2SO4 et l'air.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Potassium tert-butoxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 9 mai 2013 (JavaScript nécessaire)
- http://evans.harvard.edu/pdf/evans_pka_table.pdf « Copie archivée » (version du 2 octobre 2013 sur Internet Archive)

