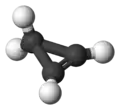
Cyclopropène
Le cyclopropène est un hydrocarbure de formule brute C3H4. C'est le plus simple des cycloalcènes imaginables. Il a une structure en triangle isocèle. Le cyclopropène est difficile à préparer et très intéressant à étudier car son cycle est très contraint ce qui le rend instable[5].
| Cyclopropène | |
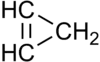   |
|
| Identification | |
|---|---|
| Nom UICPA | cyclopropène |
| No CAS | |
| PubChem | 123173 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C3H4 [Isomères] |
| Masse molaire[1] | 40,063 9 ± 0,002 7 g/mol C 89,94 %, H 10,06 %, |
| Moment dipolaire | 0,454 ± 0,010 D [2] |
| Propriétés physiques | |
| T° fusion | −36 °C[3] |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 9,67 ± 0,01 eV (gaz)[4] |
| Précautions | |
| Directive 67/548/EEC | |
 F+ |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Synthèses du cyclopropène et de ses dérivés
Synthèse historique
La première synthèse confirmée de cyclopropène, faite par Dem'yanov et Doyarenko, consiste en une décomposition thermique de l'hydroxyde de triméthylcyclopropyl ammonium sur une argile platinisée à 320 °C - 330 °C sous atmosphère de CO2. Cette réaction produit principalement de la triméthyl amine et de la diméthylcyclopropyl amine et environ 5 % de cyclopropène. Le cyclopropène a aussi été obtenu avec un rendement de 1 % par thermolyse de l'adduit du cycloheptatriène et du diester acétylènedicarboxylate de diméthyle.
Synthèses modernes à partir de chlorures d'allyle
Le chlorure d'allyle subit une déshydrogénation par traitement avec la base amidure de sodium à 80 °C pour produire du cyclopropène avec un rendement d'environ 10 %[6] :
- CH2=CHCH2Cl + NaNH2 → C3H4 (cyclopropène) + NaCl + NH3
Le sous produit majeur est l'allylamine. Ajouter du chlorure d'allyle à du bis(triméthylsilyl)amidure de sodium dans le toluène bouillant en 45 à 60 minutes produit le composé désiré avec un rendement de 40 % et une nette amélioration de sa pureté[7]:
- CH2=CHCH2Cl + NaN(TMS)2 → C3H4 (cyclopropène) + NaCl + NH(TMS)2
Le 1-méthylcyclopropène est synthétisé de la même façon mais à température ambiante avec le chlorure de méthylallyle et le phényllithium comme base[8]:
- CH2=C(CH3)CH2Cl + LiC6H5 → CH3C3H3 (1-méthylcyclopropène) + LiCl + C6H6
Synthèses des dérivés
La réaction d'un nitro-R-cyclopropane avec le méthanolate de sodium élimine le nitrite de sodium et le dérivé du cyclopropène, le R-cyclopropène, respectif. La synthèse de cyclopropènes aliphatiques purs a été faite avec la réaction suivante : en utilisant du sulfate de cuivre comme catalyseur, l'addition de dérivés carbène du diazoacétate d'éthyle à l'acétylène produit les cyclopropènes appropriés. Par cette réaction, le 1,2-diméthylcyclopropène a été formé par addition du méthylène (carbène) sur le 2-butyne, et le 1,2-diméthylcyclopropène-3-carboxylate par addition du carbométhoxycarbène sur le 2-butyne. Il a été prouvé que le cuivre est un catalyseur très utile pour la synthèse d'une large variété de cyclopropènes. Le sulfate de cuivre et le cuivre en poudre sont les deux formes les plus populaires pour cet usage.
Réactions chimiques du cyclopropène et de ses dérivés
Les études sur le cyclopropène se concentrent sur les conséquences de la forte contrainte de cycle et de son relâchement ou de son ouverture. À 425 °C, le cyclopropène s'isomérise en propyne:
- C3H4 → H3CC≡CH
Les essais de distillation fractionnée du cyclopropène à −36 °C (son point d'ébullition prédit) aboutissent à une polymérisation dont le mécanisme est une réaction radicalaire et le produit, en se basant sur son spectre RMN, semble être du polycyclopropane.
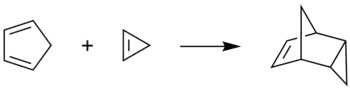
Le cyclopropène peut aussi subir une réaction de Diels-Alder avec le cyclopentadiène pour donner l'endo-tricyclo[3.2.1.02,4]oct-6-ène. Cette réaction est communément utilisée pour détecter la présence de cyclopropène après sa synthèse[7].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50
- (de) Hans Beyer et Wolfgang Walter, Organische Chemie, 20e éd., S. Hirzel Verlag, Stuttgart, 1984, p. 381. (ISBN 3-7776-0406-2).
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- Review of the Chemistry of Cyclopropene Compounds., Carter, F. L.; Frampton, V. L.; Chemical Reviews; 1964, Vol 64, pp. 497-525.
- A Simple Synthesis of Cyclopropene., Closs, G.L., Krantz, K.D.; Journal of Organic Chemistry, 1966, Vol. 31, p. 638.
- Cyclopropene: A New Simple Synthesis and Its Diels-Alder reaction with Cyclopentadiene., Binger, P.; Wedermann, P.; Brinker, U. H.; Organic Syntheses, 2000, Vol. 77, p. 254.
- An Efficient and Convenient Synthesis of 1-Methylcyclopropene., Clarke, T. C.; Duncan, C. D.; Magid, R. M.; J. Org. Chem, 1971, Vol. 39, p. 1320.
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Cyclopropene » (voir la liste des auteurs).