Cristatella mucedo
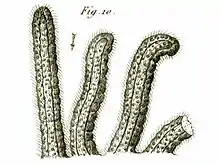
La Cristatelle, dont le nom scientifique est Cristatella mucedo est un petit animal aquatique colonial. Cet invertébré filtreur est un bryozoaire de la famille des Cristatellidae. De loin, la forme et l'aspect d'une colonie mature évoque celle d’une chenille translucide et velue (sauf pour la partie inférieure qui évoquerait plutôt le pied d’un gastéropode). La colonie, presque cylindrique, est formée de 2 à 3 rangées de polypes alignés formant au niveau de leurs base un espace ouvert partagé. Elle est issue d’un élément fondateur ; elle prend d’abord une forme arrondie de quelques millimètres de large, puis elle s’allonge peu à peu sur deux côtés pour former une sorte de tube couvert de polypes d’un côté, et formant un pied gélatineux de l’autre. Elle est presque entièrement transparente, hormis le tube digestif (bleuté à brunâtre selon la nourriture ingérée), le coenoecium (légèrement jaunâtre à brun clair). Dans la colonie, on distingue des points opaques brun-noir et bien visibles quand ils arrivent à maturité ; ce sont les statoblastes (forme dormante de l'espèce ; ils sont ronds, flottent sur l’eau et leur périphérie est dotée de filaments se terminant chacun par une sorte de minuscule grappin muni de à 1 à 2 crochets.
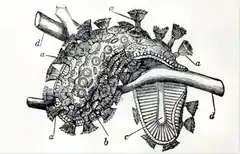
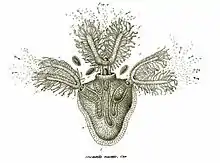
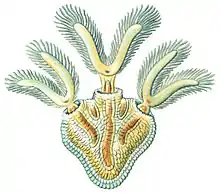
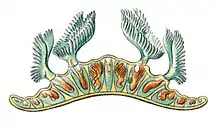
a) polypes et leur couronne de tentacules en forme de fer à cheval ;
b) statoblastes visibles à travers les tissus translucides
c) le pied (ou « sole » musculaire au moyen duquel l'animal peut lentement se déplacer d) tige submergée de renoncule aquatique
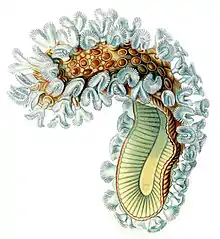
Les colonies, qui peuvent très lentement se mouvoir sont souvent parois trouvées sur des branches immergées ou sur des rhizomes de plantes. Sur les branches ou certains substrats durs ou des branches immergées, elles forment parfois des groupes évoquant une succession de chenilles processionnaires, longues d’environ 5 cm pour les plus grandes des unités coloniales.
Exceptionnellement les individus peuvent former un « tapis » (zoarium) couvrant parfois entièrement une pierre ou un objet dur qui prend alors l'apparence d'un morceau de récif corallien couvert de polypes ouverts. Tous les individus meurent en fin d'automne, mais chaque colonie produit à ce moment des dizaines de propagules très résistantes susceptibles de former une nouvelle colonie au printemps suivant. Ce bryozoaire vit dans les eaux douces, plutôt lentes, où il se nourrit de microplancton et de particules en suspension. Il est réputé préférer les eaux fraiches de la zone holarctique.
C'est l'une des environ 8000 espèces de bryozoaires connus dans le monde[1] et l’une des rares espèces d'eau douce (environ 1 espèce de bryozoaire sur 1000 vit en eau douce, presque tous appartenant à la classe des Phylactolaemata qui regroupe des espèces ne vivant qu'en eau douce). C'est aussi la seule espèce du genre Cristatella[2], décrit par Georges Cuvier en 1798 dans son ouvrage « Tableau élémentaire des animaux ». Cette espèce d’abord décrite par Rösel n’a pu être mieux étudiée que des décennies plus tard, dont par le naturaliste irlandais George James Allman qui a consacré une partie de sa vie aux bryozoaires d’eau douce.
Origines, phylogénie, paléontologie



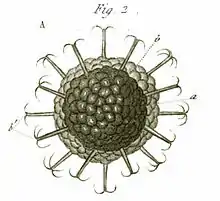
Planche d'illustrations tirée d'une monographie de George James Allman consacrée aux Phylactolaemata parue en 1856[6]
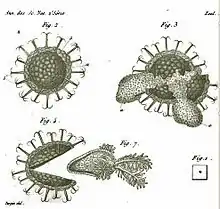
En bas : Cet autre statoblaste s'est naturellement ouvert (le 15 décembre 1837), libérant l'organisme (voir détail ci-dessous) qui constitue le premier stade d'une colonie potentielle de cristatelle, et permettant à l'auteur (Pierre Jean François Turpin) de réaliser ce dessin d'après nature, publié et présentée à l'Académie des sciences cette même année 1837
Ces deux Statoblastes avaient été trouvés par l'auteur dans le canal de l'Ourcq[7].
C'est cette observation qui a convaincu l'auteur et les zoologistes que la Cristatelle est un vrai polypier et non la simple réunion de polypes individuels. Ce polypier né prématurément en raison d'une température élevée de l'eau n'a survécu que 3 jours, mais a eu le temps selon l'auteur de pondre 3 œufs ovales (représentés sur la gravure)[7]
(Dessin original de P.J.F Turpin, 1837)






_03.jpg.webp)
Cet animal gélatineux et fragile se dégrade rapidement après sa mort et se fossilise donc très mal. Cependant, ses statoblastes, dont la forme est caractéristique se fossilisent plus facilement. De nombreuses fouilles, sondages et études limnologiques en ont mis au jour, par exemple dans les sédiments déposés durant les époques interglaciaires et depuis la dernière glaciation au Groenland[8] - [9] ou au Canada[10].
Leur présence dans un sédiment récent ou dans une roche sédimentaire ancienne doit néanmoins être interprétée avec prudence, car munis de flotteur et pouvant s’accrocher aux oiseaux (exo-zoochorie), ou être ingérés par eux et voyager dans leur tube digestif (endozoochorie) ou être transportés par des poissons (endozoochorie) ou dispersé par des crues, leur nombre et leur abondance ne sont pas nécessairement représentatifs du nombre de colonies autrefois présentes à l’endroit où ils ont été trouvés[11]. Selon Massard & al. (2008)[12], au sein du groupe Phylactolaemata, les espèces gélatineuses (Lophopodidae, Pectinatellidae, Cristatellidae) sont phylogénétiquement plus ancienne et primitives que le groupe Gymnolaemata et ses espèces tubulaires ramifiées (Plumatellidae, Fredericellidae)[12].
Histoire scientifique de la découverte, description et classification de la Cristatelle
Très peu d'information sont disponibles sur le statut et la répartition de cette espèce avant que les naturalistes s’y intéressent de manière plus approfondie au XVIIIe et surtout au XIXe siècle.
Cet animal est assez remarquable pour ne pas passer inaperçu et là où il est présent peut aisément être observé à quelques centimètres sous la surface. Or, il n'a pas été mentionné par les naturalistes avant les années 1700, bien que ces derniers aient passé beaucoup de temps à étudier la faune et la flore des mares et des zones humides de toute l'Europe de l'Ouest et peu à peu de l'Amérique du Nord. Ceci laisse supposer que l'espèce était rare ou peu commune dans une grande partie de sa vaste aire de répartition, et notamment dans les zones anthropisées.
Cuvier lui-même, selon G.J Allman, n'aurait pas pu se procurer d’exemplaires de C. mucedo pour sa description scientifique et sa classification, et il a du comme plus d’une dizaines d’autres naturalistes après lui utiliser une description graphique faite par le peintre et illustrateur naturaliste allemand August Johann Rösel von Rosenhof dit « Roesel ». Et plus tard, Gervais écrit « les plumatelles sont beaucoup plus fréquentes que les cristatelles (...) Leurs œufs sont même connus depuis fort long-temps : Rösel les a pris pour des graines de lentilles d'eau, mais avant lui Bernard de Jussieu et M. de Réaumur avait déjà reconnu leur véritable nature » (ils avaient observé la "ponte" et « ont vu naitre des petits de ces œufs »).
Un autre indice de rareté réelle ou relative (comparativement aux autres bryozoaires) est qu’une espèce parente, bien plus petite et plus discrète plumatella repens décrite par Linnée en 1758 comme un bryozoaire dulcicole rampant était considérée comme abondante par les naturaliste (dont par Allman). Ce cernier quand il décrit C. mucedo prend la peine de lister les quelques lieux où l'animal a à sa connaissance pu être observé en Europe continentale : le Lac de Lucerne, le Grand étang de Fontainebleau, près de Paris par Gervais et Turpin, en Belgique par Van Beneden et en Allemagne par Rösel) et dans les eaux insulaires de Grande-Bretagne par lui-même ou d'autres naturalistes (dans le réservoir d'eau d'un moulin à eau près de Little Baddow dans l'Essex, dans un beau lac subalpin près de Glandore dans le Comté de Cork, dans les Lacs de Killarney, dans un lac situé près d'Armagh et dans plusieurs autres localités irlandaises (GJA), le lac de Duddingston à Duddingston près d'Édimbourg, le Lac de Coldingham à Berwick, une mare de jardin à Binns House dans le Linlithgowshire où l’espèce a été trouvée par JG Dalyell. L'espèce nous dit-il a aussi été observée dans le « canal de l'Union » (construit de 1818 à 1822, sur 50,7 km et sans écluse pour relier le bassin d'Édimbourg à celui de Falkirk) et dans le Grand Canal (Irlande) de Dublin. Cette information est rétrospectivement intéressante, car elle montre la capacité de ce bryozoaire à rapidement coloniser des milieux aquatiques artificiels créés par l'homme.
Durant un siècle ce sont encore les mêmes illustrations ou d’autres faites d’après les premières, plus ou moins bien recopiées sous forme de gravures ou de lithographies qui ont servi à illustrer les articles scientifiques ou de vulgarisation concernant l’espèce et le genre. Rösel a notamment fait de remarquables dessins scientifiques d’amphibiens, et pour mieux observer les animaux avait l’habitude d’emporter des œufs ou larves et de les élever chez lui, ce qui lui permettait d'étudier leurs développements et leurs métamorphoses. C’est peut-être ainsi qu’il a pu découvrir l’espèce et ensuite, après une observation attentive, produire la première planche de dessin naturaliste présentant C. mucedo, espèce qui a rapidement fasciné de nombreux naturalistes.
Le premier spécimen adulte "parfait" aurait été décrit par le naturaliste écossais John Graham Dalyell (1775-1851) en 1834 à partir d’un individu découvert dans les années 1830 près d'Edinbourgh, et présentant une forme et des caractéristiques différentes de celles correspondant aux descriptions faites jusqu'alors. Dalyell nomme alors l’animal qu’il décrit Cristatella mirabilis et le décrit clairement comme appartenant aux espèces « rares et remarquables » d'Écosse.
En France, le zoologiste français Henri Frédéric Paul Gervais en décrit ensuite un autre spécimen colonial mature. De son côté Allman recherche activement l'espèce en Grande-Bretagne, et en découvre d’autres spécimens en Irlande.
Les naturalistes de l'époque le décrivent souvent comme un très bel animal ; « A more interesting and beautiful animal than a fully developped specimen of Cristatella mucedo can scarcely be imagined » (On peut difficilement imaginer un animal plus beau et plus intéressant qu’un spécimen entièrement développées de Cristatella mucedo) écrivait G.J Allman dans sa Monographie sur les bryozoaires d’eau douce)[13]. C’est lui qui déduit de ses observations faites dans la nature que les individus de cette espèce meurent tous systématiquement en hiver (il n'en a jamais vu nulle part après l’automne écrit-il en 1856[14])
L’espèce sera un peu plus facile à observer quand les aquariums seront disponibles pour les naturalistes et le grand public ; ils ont été source d'un nouvel engouement pour l'étude des organismes aquatiques d'eau douce et marins, y compris invertébrés (popularisés par les travaux très richement illustrés de Philip Henry Gosse (1810-1888) en Grande-Bretagne et des illustrations d'Ernst Haeckel (1834-1919) en Allemagne ainsi que grâce à l’œuvre de vulgarisateurs tels que Sir John Graham Dalyell (1775-1851).
C. mucedo sera en quelque sorte ensuite redécouverte par le naturaliste et célèbre illustrateur Pierre Jean François Turpin et son collègue naturaliste Gervais des années après Rösel et Cuvier, quand ils ont observé la formation d’invertébrés coloniaux à polypes à partir de statoblastes trouvés à Paris par Turpin à l'automne 1836 non loin du Muséum de Paris dans les débris de végétaux flottants apportés par le Canal de l'Ourcq. Turpin et Gervais à qui il les montre prennent d'abord ces quelques statoblastes pour de minuscules graines végétales (peut être d'Erisyphe propose d'abord Turpin), puis pour des œufs d'une espèces inconnue. Ils en emportent chacun quelques exemplaires. Ils les observent au microscope et sont tous deux intrigués par le fait qu'ils soient entourés d' « épines à crochets » ; « Quelle est la malheureuse mère contaminée à pondre des œufs si horriblement hérissés ? » s'interroge Turpin. Ils remarquent tous deux que ces œufs ressemblent, mais pas tout à fait à des éléments de l'illustration de Rössel ; Turpin écrase un de ces œufs, et au vu du contenu apparemment albumineux exprimé, estime qu'il contenait un embryon. Ayant conservé un autre de ses œufs dans une « petite fiole débouchée » dont il renouvelle l'eau chaque jour, il assiste à son éclosion, qu'il décrit comme suit pour l'Académie des sciences : Vers le, 15 de décembre, en regardant le matin, comme de coutume, ma petite fiole placée ‘entre l'œil et la lumière, je vis avec surprise que l'œuf s’était ouvert en deux valves béantes (1), qui n'adhéraient plus entre elles que par un seul point, de la même manière que s'ouvrent les deux valves d'une huître. Ne pouvant douter qu'il ne se fût échappé quelque chose de cette coque bivalve, je jetai les yeux dans le voisinage, et ÿ aperçus un petit animal composé, fort élégant, que je reconnu de suite pour appartenir au groupe des Polypes, et être celui superficiellement figuré et ‘très multiplié par Rœsel (a), et nommé par. Georges Cuvier Cristatella mucedo et Cristatella vagans. (3)(...)[15] - [16]. Il explique qu'au vu de cet organisme fondateur, il a compris que C mucedo n'est pas comme on le pensait jusqu'alors un « polype nu », mais bien un « polypier ascidiforme » ; (« Cette enveloppe qui est, sans contredit, un véritable polypier, empêche que l’on ne considère plus long-temps, la Cristatelle comme étant un polype nu »). Il explique que quand il sort de l'enveloppe qu'il avait pris pour un œuf, ce polypier abrite déjà trois individus (3 polypes) ; les deux latéraux, plus petits et nés du premier par « gemmation » (c'est-à-dire par bourgeonnement) étant ceux qui fonderont la colonie de part et d'autre du premier en lui donnant sa forme de chenille. Turpin utilise devant l'Académie la métaphore suivante : « On ne peut mieux comparer cette trinité de Cristatelles qu'à un végétal dont la tige principale aurait produit, par extension de ses nœuds vitaux, deux bulbilles latérales qui ensuite se seraient isolées et développées en deux autres petites branches » ajoute-t-il. Gervais observe aussi l'éclosion de statoblastes, mais les deux naturalistes ne parviennent pas à maintenir en vie plus de trois jours le spécimen de Turpin. Ce dernier a néanmoins le temps d'observer, dessiner et décrire la production étonnante de plusieurs minuscules œufs ovales par son polypier pourtant "nouveau-né".
C’est l'une des premières espèces décrites dans ce qui deviendra le groupe dit polyzoa (polyzoon pour les anglophones), mais elle figurera durant plusieurs décennies parmi les polypaires douteux, c'est-à-dire dont la position taxonomique n'a pu être précisée avec certitude ; Cuvier classe d'abord l'espèce après les hydres, entre les Corines et les Vorticelles, et en 1817, il rapproche la cristatelle de Tubularia repens, mais ce dernier est alors synonyme de Tubularia campanulata, classé dans une autre famille (campanulaires), deux erreurs et incohérence taxonomiques qu'il corrigera ensuite. Lamark rapproche lui la cristatelle d'autres polypiers fluviatiles mais la nomme Cristatella vagans
En 1835, peu avant les publications de Gervais (mars 1837)[17] et Turpin (janvier 1837)[18], un auteur confond encore la cristatelle avec un végétal[19], en faisant une double erreur, car il semble l'avoir confondu avec un spongille qui est en fait une éponge et donc aussi un animal, mais le caractère animal de l'éponge n'était pas encore démontré et l'une de ces éponges (spongilla lacustris, parfois trouvée près des cristatelles, peut vivre en symbiose avec une algue verte et produire des bulles d'oxygène, ce qui pourrait avoir trompé l'auteur).
La description générique qu'en fait un peu plus tard Allman est :
- « Coenoecium scciform, hyaline, with a common flattened discadapted for locomotion ; orifices placed ont the surface opposite to the disc, and arranged in several concentric marginal series. Statoblasts orbicular, with an annulus and marginal spines ».
Synonymie
Jusqu’à ce que son nom soit fixé (sous réserve de nouvelle dénomination à la suite des avancées de la taxonomie), les naturalistes l’ont nommé * * Cristatella vagans (Lamsk en 1816), Schweiger en 1820 et Lamouroux en 1824, Golfuss en 1824, De Blainville en 1834, Lamark en 1836, )[20]
Description
Parmi les bryozoaires d’eau douce, les individus coloniaux sont de grande taille (mais ne forment pas de superorganisme géant comparables aux boules gélatineuses formées par Pectinatella).
Leurs statoblastes ont la forme d’une petite soucoupe volante dont une face serait un peu plus convexe que l’autre. Ils sont également parmi les plus grands connus chez les bryozoaires, et ils sont les seuls avec ceux de pectinatella à disposer (à maturité) d’un anneau orbiculaire d’une couleur jaune pâle et d’une texture différente (cellules différentiées). Ce statoblaste se différentie aussi des autres par des filaments périphériques (parfois qualifiés d’épines) se terminant en petites ancres ou grappins tout à fait caractéristiques. Ces filaments foncés prennent naissance sur les deux faces du stabolaste et non à sa périphérie. Ceux qui émergent de la face la plus convexe du statoblaste sont plus longs et plus nombreux que qui sont sur l’autre face. Chaque filament se termine par une sorte de petit grappin à deux, trois ou quatre crochets recourbés (curieusement, les statoblastes ne s’accrochent pas ou peu entre eux).
Vers la fin de l'été, les nombreux statoblastes produits par l’animal sont encore stockés à l'intérieur de l’organisme colonial (ils sont bien visibles à maturité, au travers des tissus transparents de l'animal). En cas de stress important des statoblastes peuvent être mécaniquement expulsés par l’animal colonial vivant, sinon, c’est à la mort de la colonie, lors de la décomposition du « coencoecium » que la plupart des statoblastes sont libérés dans le milieu.
Ceux-ci flottent, et grâce à leur multiples de petites « ancres » ils vont s’attacher à des algues, des plantes aquatiques, ou encore à des poils d’animaux ou à des plumes d’oiseaux aquatiques. Plusieurs mois après, une fois l’hiver passé, les statoblastes encore vivant vont s’ouvrir et libérer un jeune individu au printemps voire en début de l’été suivant. Ce jeune individu pourra par reproduction clonale (bourgeonnement latéral) produire une nouvelle colonie.
Le nombre de minuscules tentacules de chaque polype (environ 18) est plus important que chez la plupart des autres espèces de bryozoaires (sauf peut être pour Pectinatella Leidy) selon Allman.
Distribution
Cette espèce est trouvée en Europe du Nord et de l'est dont au Royaume-Uni, Norvège, Finlande et aux Pays-Bas du niveau de lamer jusqu’à 1 116 m d’altitude (record enregistré en Norvège lors d’une étude de près de 20 ans ayant porté sur l’inventaire de 601 lacs) [24], ainsi que dans le Nord-Est de l’Amérique du Nord et au Canada[25] - [26]. Elle a été signalée au Japon dans les années 1930[27].
Capacité de dispersion
Bien que les jeunes individus et les entités coloniales aient de très faibles capacités de dispersion active (elles se mesurent en cm ou quelques cm par jour au mieux), cette espèce dispose d’importantes capacités de dispersion passive (centaines à milliers de km en quelques jours à semaines) :
- hydrochorie : des individus coloniaux accrochés à une branche immergées emportée par le courant ou une crue peuvent être transportés et se reproduire en aval, mais ceci n’expliquerait pas la très large répartition géographique des individus au sein des sous- populations et de la métapopulation de l’espèce.
- Ornithochorie : Selon Bourgogne-Nature, « Il a été vérifié que le transit intestinal de n’altérait pas le pouvoir germinatif des statoblastes, mais on peut cependant faire remarquer que la durée du transit est brève chez bien des oiseaux, et donc la longueur du trajet courte, alors que l’exo-ornithochorie permet sans aucun doute des déplacements sur de bien plus longues distances »[28] voir page 7/11; Une hypothèse était donc que les oiseaux d’eau puissent transporter des statoblastes sur de très grandes distances (de même que pour des crustacés cladocères tels que Daphnia ambigua, Daphnia laevis et Sida crystallina qui tous produisent des propagules très résistantes à la dessiccation et qui montrent une capacité remarquable à coloniser rapidement de nouveaux milieux isolés) ;
Cette hypothèse semble pouvoir être confirmée par les résultats d’une étude publiée en 2005. Cette étude a porté sur les distances génétiques entre populations géographiquement dispersées dans toute l’Amérique du Nord. Elle a conclu que les distances génétiques observées peuvent effectivement être, au moins en grande partie, expliquée par les corridors de migration aviaire (les trajets et mouvements des oiseaux aquatiques migrateurs) en Amérique[29] - [30] - [31].
Le sort de cette espèces pourrait donc aussi être lié à l’état des populations d’oiseaux qui les transportent ; toute disparition ou régression significative de certains oiseaux d’eau fréquentant les habitats de C mucedo (en raison d’effets dus à la chasse par exemple, car beaucoup de ces oiseaux sont aussi des espèces-gibier) , ou toute modification importante de l’aire de répartition de ces oiseaux (en raison du dérèglement climatique par exemple) pourraient avoir des effets collatéraux sur C mucedo. Dans d’autres cas, les activités humaines semblent aussi expliquer le recul ou parfois les avancées ou changements d’aire d’autres espèces de bryozoaires[31]. L’eutrophisation ou le creusement de canaux entre différents bassins versants pourrait localement avoir favorisé le développement de certaines populations de C. mucedo. - Une autre hypothèse est que des poissons pourraient ingérer des statoblastes et que ces derniers pourraient parfois résister à la digestion et être alors transporté vers l’amont ou l’aval si les poissons sont « migrateurs » en dévalaison ou en remontée.
Ces capacités de dispersion expliquent le fait, noté par Darwin en 1859, que les bryophytes d'eau douce montrent une étonnante capacité à coloniser des milieux apparemment isolés et physiquement déconnectés les uns des autres ; ces capacités ont une grande importance à moyen et long terme pour les flux de gènes et les divergences évolutives et à court terme pour les phénomènes de (re)colonisation et de résilience écologique.
Génétique, variations du génome et diversité génétique
Bien que l’essentiel de la reproduction des polypes et colonies est clonale, une diversité génétique significatives a été signalée entre toutes les populations étudiées. Les progrès récents des outils de biologie moléculaire ont permis de trouver que chez les bryozoaires[32] (et notamment chez C. mucedo pour la première fois en 1994) des preuves génétiques directes de fécondation croisée, même si celle-ci ne semble générer que de faibles niveaux de variation génétique au sein des populations d’un même site qui sont très clonales[33]. La première explication de la variété génétique de la Cristatelle et d’autres bryozoaires reste donc la capacité de dispersions à grande distance que lui confère la production d’un grand nombre de statoblastes, qui joue probablement un rôle majeur dans l’entretien de cette diversité.
La Cristatelle a récemment fait l’objet d’études génétiques relativement poussées (études des microsatellites et séquences mitochondriales de gènes) en Europe[34] et en Amérique du Nord[35].
Les gènes mitochondriaux montrent l’existence de nombreuses lignées divergentes, qui en Amérique du Nord semblent pouvoir être classées en deux grands groupes au sein de la métapopulation étudiée. Un premier groupe est génétiquement relativement homogène et contient des haplotypes assez similaires à ceux observés en Europe, alors que le second groupe est plus hétérogène et éloigné des génomes européens, avec une divergence relativement récente (au regard des rythmes de l’évolution), qui pourrait remonter selon les données disponibles à environ 1,5 million d’années avant nos jours[36].
Selon les données disponibles, les populations européennes ne renfermeraient que trois haplotypes, étroitement liés entre eux. Les niveaux de variation génétique intra-population sont comparables en Amérique du Nord et en Europe, cependant les données microsatellites révèlent une diversité génétique nettement plus élevée en Amérique du Nord qu'en Europe, peut être en partie en raison des effets différents des dernières glaciations, mais la combinaison des données mitochondriales et microsatellites suggère aussi que ces deux grandes lignées nord-américaines, génétiques nettement distinctes pourraient représenter deux espèces cryptiques ; les hybridations entre ces deux quasi-espèces expliqueraient alors (au moins partiellement) des niveaux élevés de diversité génétique en Amérique du Nord.
Habitats
C’est une espèce qui est réputée associée aux eaux plutôt fraiches et aux climats froids à tempérés.
On a récemment montré qu’existent néanmoins des variants génétiques différents (en Amérique du Nord), dont certains pourraient être adaptés à des milieux légèrement différents.
En Europe, selon une étude norvégienne réalisée de 1960 à 1978 sur 601 lacs du niveau de la mer au niveau des montagnes[37], C. Mucedo supporte les hivers très froids bien qu’un peu moins que P. articulata et peut être trouvé dans des environnements variés, mais avec une préférence marquée pour les lacs situés à une altitude moyenne, avec une eau plutôt chaude en été, un faible effet des vagues, un taux moyen à élevé de calcium en solution, un taux moyen de magnésium, une eau légèrement acide et moyennement turbide[37].. C. mucedo semble indifférente au niveau trophique (à condition d’avoir assez de calcium et magnésium), mais évite les lacs d’altitude très froids et les lacs acides ou acidifiés (l’espèce n’est pas retrouvée dans les eaux dont le pH est sous 5.4) ni dans les lacs dont l’eau est trop limpide (limpidité associée à l’absence de nourriture nécessaire aux bryozoaires) [37]. Selon Allman, ces animaux vivent dans des eaux de « lacs et de mares, sur la partie supérieure de pierres submergées, et sur les rhizomes de plantes aquatiques où elles glissent lentement, se complaisant dans la lumière du soleil ». Selon certains auteurs, ils peuvent être trouvés dans des habitats lentiques et parfois lotiques[38], et peuvent aussi coloniser des masses d’eaux récemment constituées dans des gravières ou fonds de carrières (par exemple dans l'ancienne carrière dite le « lac bleu » à Rœux[39].
Une étude des populations de bryozoaires de la rivière Sûre au Luxembourg, a mis en évidence que les groupes de cristatelles étaient centrées sur le lac de barrage du barrage de la haute-Sûre (comme plamatella fungosa) ou juste à son aval alors que d'autres bryozoaires (Plumatella repens ou Plumatella emarginata étaient présentes respectivement sur la totalité et presque totalité du cours d'eau, ce qui laisse supposer que la Cristatelle apprécie les eaux ralenties (lentiques) et/ou bénéficiant d'une bonne inertie thermique.
Cette même étude montre que l'espèce semble avoir disparu, de même que toutes les autres espèces de bryozoaires d'une section de la rivière, où la seule explication trouvée était la pratique intense de la baignade et du canotage près d'une zone touristique et de camping[40].
Biologie
Cette espèce vit selon un cycle annuel, et forme des colonies dites “ statoblastiques”[41] et semble à la fois adaptée à des habitats lentiques (ex : lacs, eau ralentie par un barrage) et relativement lotiques (canal, petit cours d'eau)[42] qui meurent en hiver en laissant les statoblastes qui constituent pour les bryozoaires d’eau douce un stade de dormance hivernal[43].
Son organogenèse[44] et son système nerveux (dès le début du XXe siècle)[45] et en particulier ses neurones[46] très primitifs, ont fait l’objet d’études.
Alimentation
Comme tous les bryozoaires, la cristatelle est microphage. Elle filtre l'eau grâce aux tentacules ciliés de ses lophophores qui amènent ensuite les particules retenues vers sa bouche.
Cette espèces pourrait ainsi dans une certaine mesure contribuer à l'autoépuration des eaux.
Allman remarque aussi qu’à la différence de la plupart des autres bryozoaires d’eau douce, C. mucedo laisse la plupart du temps ses tentacules en extension, en position ouverte étendue dans l’eau. Si un contact ou un stress provoque le retrait du panache ce tentacule dans la cellule, il en ressort aussitôt « dès la gêne passée »...
Motilité
Selon Allman, en captivité, les grands individus coloniaux se déplacent peu et « avec réticence », mais les individus plus petits (un peu plus de 1 cm) peuvent parcourir jusqu’à plus de 10 cm par jour le long des parois du bocal où ils sont maintenus.
Selon Allman, ils préfèrent se maintenir près de la surface et semblent apprécier la lumière (mais dans la nature on trouve parfois des colonies denses à plus d’1 m de profondeur dans une eau très turbide, toutefois du côté le plus éclairé des substrats durs qu’ils colonisent).
La colonie ne possède pas de cerveau, et on ignore encore les principes qui guident cet ensemble de polypes dans leur déplacement (le long d’une tige, d’une paroi ou sur objet). De nombreux auteurs signalent une forme d’attirance pour la lumière.
Reproduction
Les polypes sont hermaphrodites et une reproduction sexuée est possible via la spermatogenèse[47] et une fécondation croisée des ovaires, mais elle est minoritaire : la colonie se reproduit principalement de manière clonale.
Elle produit en outre des propagules (les « statoblastes », qui résultent aussi d’une multiplication asexuée). Les statoblastes sont chez cette espèce, de grande taille. Ils ont une forme de soucoupe volante, et abritent du matériel germinatif. Ils sont entourés d’un « anneau pneumatique » périphérique (flotteur) qui leur permet de flotter et de se disperser dans l'eau ; ce sont des flottoblastes. Quelque statoblastes resteront « collés » à leur colonie-mère (on les nomme sessoblaste)
Le statoblaste est constitué de deux « valves », l'une dorsale, l'autre ventrale, réunies par suture.
Les statoblastes qui sont formés de la fin du printemps à l’été peuvent être libérés par la désagrégation accidentelle partielle ou totale de la colonie. Durant l'automne, toutes les colonies meurent et se décomposent en libérant les très nombreux statoblastes qu’elles contiennent. Ces derniers hiverneront en état de quiescence puis « germeront » dès que la température de l'eau remontera suffisamment. Une phase de reproduction sexuelle intervient ensuite : les colonies peuvent libérer des larves (juillet, août) qui après avoir d'abord nagé librement dans l'eau, se fixent après métamorphose pour former de nouvelles colonies (reproduction sexuée). Ces colonies bien que plus jeunes, tout comme leurs colonies parentales produiront aussi des statoblastes qui assureront la reproduction asexuée de l'espèce.
Dynamiques des populations
Selon les données disponibles sur les patterns écopaysagers de répartition de l’espèce et sur les caractéristiques abiotiques (physicochimie) des sites, ou selon les données acquises via des analyses génétiques ou des expérimentations de transplantation, il semble qu’à l’échelle d’un bassin naturel, l’espèce forme des populations locales fortement clonales, qui constituent une métapopulation.
On suppose que cette structure évolue très peu du printemps à l’automne, mais elle peut évoluer via les mouvements de statoblastes d’une année sur l’autre. Les qualités physicochimiques de l’eau ne sont pas prédictives de la présence/absence de l’espèce. Il est fréquent que des sites a priori favorables demeurent inoccupés. Des phénomènes d’extinction et de recolonisation de sous-population au sein d’une métapopulation sont observés et encore mal compris.
Une faible part des colonies produisent des larves issues de reproduction sexuée, dont l’espérance de survie après quelques mois est mal connue. L’aspect fortement clonal (homogénéité génétique) des sous-populations locales est supposé accroitre la probabilité d'extinction locale en cas d’attaque parasitaire ou de conditions biotiques ou abiotiques défavorables. Mais d’autre part, une croissance clonale rapide et une production massive de propagules issues d’une reproduction asexuée sont des traits de sélection r, qui semblent constituer une stratégie écologique payante pour les bryozoaires d'eau douce fixés, dont les populations subissent un relatif isolement et se renouvellent annuellement entièrement après la dormance hivernale des statobaste[48].
Prédateurs, maladies
Les prédateurs et maladies des bryozoaires d'eau douce sont encore mal connus.
Dans la nature, comme les éponges d’eau douce, avec lesquelles ils cohabitent souvent, ils semblent souvent épargnés par les poissons, il est probable que les canards et d’autres animaux soient capables de les manger sous l'eau.
Cristatella peut être parasitée par
- des champignons microscopiques endoparasites (Microsporidies, appartenant au groupe des Microsporidiomycota1, anciennement dit « Microsporidia »
- des vers parasitent les cavités digestives de divers bryozoaires [49]
- une microsporidie semble spécifique à l’espèce ; elle colonise le cytoplasme de cellules de la cristatelle, dans l’intérieur des cellules de la paroi du corps de son hôte [50]. Ce parasite est diplocaryotique à tous les stade ;. Les sporogonies sont probablement disporoblastiques[50]. Les spores mesurent 7,5 x 5,1 µm et présentent un tube polaire à 22 à 32 spires, disposées en plusieurs rangées et un polaroplaste en forme de cloche, formé de membranes compactes. Le parasite serait une nouvelle espèce attribuée au genre Nosemaas ; il a été baptisé Nosema cristatellae[50]; il se différencie des parasites décrits précédemment chez d’autres bryozoaires proches par les caractéristiques de ses spores et une spécificité tissulaire. Bien qu'il ait été observé (P. fungosa) on ignore si N. cristatellae peut réelleement les infester[50].
Leur mode d’alimentation les prédispose à ingérer de nombreuses variétés et de bactéries, mycobactéries, virus et cyanophycées capables de sécréter des toxines, et plus encore des parasites Myxozoaires (vaste groupe de parasites microscopiques aquatiques dont plusieurs milliers d’espèces ont déjà été identifiées), mais les bryozoaires semblent doués d’une bonne immunité quand les conditions du milieu leur sont favorables. Comme chez les autres bryozoaires d’eau douce, le cycle annuel et la phase « statoblaste » hivernale de C. mucedo protège sans doute de certaines épidémies.
Leur reproduction majoritairement clonale du printemps à l’automne devrait les rendre vulnérables durant cette période à des infestations parasitaires, mais une réelle diversité génétique existe au sein des populations de bryozoaires, indépendante des distances géographiques entre populations[51] ; un polymorphisme des loci microsatellite est constaté dans les organismes hautement clonaux[52], et il semble exister des mécanismes de coévolution ou d’interactions durables encore mal compris entre hôtes et parasites[53].
Des indices issus de la biologie moléculaire laissent penser que la Cristatelle fait partie des bryozoaires susceptibles d’être porteur et/ou vecteur ou hôte intermédiaires d’un de ces parasites du phylum Myxozoa [54]. Ce parasite qui a d’abord été nommé Tetracapsuloides bryosalmonae puis Myxosporidium bryozoides a une signature génétique désormais bien connue[55] - [56], mais au début des années 2000 son cycle de développement reste mystérieux) ; la Recherche halieutique lui porte une grande attention car dans les piscicultures ce parasite est responsable d’une maladie émergente, la tétracapsulose à Tetracapsula bryosalmonae ; il semble (selon les données génétiques) originaire d'Amérique du Nord, mais aurait pu être introduit en Europe avant les grands transferts de poissons par les pisciculteurs et pêcheurs. Ce parasite s'attaque à certains poissons qui réagissent avec une vive réaction immunopathologique au niveau des reins et de la rate des salmonidés[57], ce qui contribue à rejeter le parasite dans l’environnement lors de la guérison[58] de poissons de grand intérêt commercial (salmonidés)[54]. Des morceaux d’ADN[59] de ce parasite ont été trouvés dans l’organisme de C mucedo, ainsi que chez d’autres bryozoaires beaucoup plus fréquents (Plumatella rugosa) ou introduit et potentiellement invasifs (Pectinatella magnifica). Cette signature génétique peut être interprétée de plusieurs façons : elle pourrait signifier que les bryozoaires sont aussi porteurs, voire réservoirs en tant que porteur sain ou hôte intermédiaire potentiels de ce parasite, et éventuellement qu’ils l’ingèrent, ou les deux à la fois. Une hypothèse est que « au moins certaines variantes de ces nouveaux myxozoaires » sont capables d'infecter des salmonidés « en eau chaude (> 14-17 °C) »[57] et de s’y multiplier ; ils y stimuleraient la réaction immunitaire et provoqueraient le PKD mais sont incapables de former des spores matures pour compléter leur développement.
Un autre parasite génétiquement assez proche du précédent, mais non identique a aussi été récemment identifié ; il semble s’agir d’un myxozoaire malacosporéen (mais différent de Tetracapsula bryozoides ou T. bryosalmonae)[60].
Illustrations : Le statoblaste
_Lamiot.jpg.webp)
Au stade final, le microscope montre que à la fois la couronne et les deux faces du statoblaste ont un aspect réticulés[62].
Les statoblastes jouent notamment le rôle d’une « banque de gènes » qui permet un flux temporel de gènes et l’entretien de la diversité génétique des métapopulations de bryozoaires[63]
Voir aussi
Articles connexes
Microscopie 3D
Liens externes
- photos de propagules (statoblastes) de Cristatella mucedo
- Statoblast introduction
- SEM Studies of Statoblasts of the Bryozoan, Cristatella mucedo Department of Biological Sciences, Lethbridge, Alberta, Canada
Bibliographie
- Davenport CB. 1890. Cristatella : The origin and development of the individual in the colony. Bull Mus Comp Zool 20:101–151
- Figuerola J, Green AJ, Michot TC () “ Invertebrate eggs can fly: evidence of waterfowl-mediated gene flow in aquatic invertebrates”. Am Nat. 2005 Feb;165(2):274-80. Epub 2004 Nov 29 (résumé)
- Hatton-Ellis, T. W. (1997). The molecular ecology of Cristatella mucedo (Bryozoa: phylactolaemata) in space and time (Doctoral dissertation, University of Bristol).
- Lacourt AW (1968) A monograph of the freshwater Bryozoa-Phylactolaemata. EJ Brill.
- Schwaha T, Handschuh S, Redl E, Walzl MG (2010) “Organogenesis in the budding process of the freshwater bryozoan Cristatella mucedo Cuvier, 1798 (Bryozoa, Phylactolaemata)”; J Morphol. 2011 Mar;272(3):320-41. doi: 10.1002/jmor.10915. Epub 2010 Dec 10 (résumé).
- Shunkina KV, Zaytseva OV, Starunov VV, Ostrovsky AN (2014) Sensory elements and innervation in the freshwater bryozoan Cristatella mucedo lophophore. ; Dokl Biol Sci. mars 2014;455(1):125-8. doi: 10.1134/S0012496614020136. Epub 2014 Mai (pas de résumé).
- Figuerola J, Green AJ, Michot TC () “ Invertebrate eggs can fly: evidence of waterfowl-mediated gene flow in aquatic invertebrates”. Am Nat. 2005 Feb;165(2):274-80. Epub 2004 Nov 29 (résumé)
- Stephan Handschuh, Thomas Schwaha & Brian D Metscher ()BMC Developmental Biology 2010, 10:41 doi:10.1186/1471-213X-10-41(cc-by-sa 2.0) Showing their true colors: a practical approach to volume rendering from serial sections
Notes et références
- Ryland, J., 2005. Bryozoa: an introductory overview. Denisia 16: 9–20
- « advances/disease/cristatella-mucedo/index.html Cristatella mucedo »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
- Muka H (1999), Comparative morphological studies on thestatoblasts of lower phylactolaemate bryozoans, with discussion on the systematics of Phylactolaemata. Science Reports of the Faculty of Education Gunma University 46: 51–91.
- La seconde sorte de Polypes à Bouquets. Ledermuller, Amusm. Mic. 2de cinq., p. 94, pl 87 (les figures sont des copies imparfaites des illustrations de Rösel)
- Rösel dans un article intitulé «Der Kleinere Federbusch-Polyp mit dem ballenförmigen Körper» en 1755
- Allman (1856) A monograph of the fresh-water polyzoa including all the known species, both British and foreign
- Source : "Annales des sciences naturelles comprenant la zoologie, la botanique, l'anatomie, et la physiologie comparée des deux règnes, et l'histoire des corps organisés fossiles", seconde série, Tome VII, imprimé chez Paul Renouard, Paris, 417 pages
- FREDSKILD B & RØEN U (1982). Macrofossils in an interglacial peat deposit at Kap København, North Greenland. Boreas, 11(3), 181-185 (résumé).
- Fredskild, B. (1977) The development of the Greenland lakes since the last glaciation. Folia limnol. scand, 17, 101-106.
- Kuc, M. (1973) Fossil statoblasts of Cristatella mucedo Cuvier in the Beaufort Formation and in interglacial and postglacial deposits of the Canadian Arctic. Ottawa: Department of Energy, Mines and Resources
- Osborne, P. J. (1972). Insect faunas of late Devensian and Flandrian age from Church Stretton, Shropshire. Philosophical Transactions of the Royal Society of London. B, Biological Sciences, 263(852), 327-367. (résumé)
- Massard, J. A., & Geimer, G. (2008). Global diversity of bryozoans (Bryozoa or Ectoprocta) in freshwater. In Freshwater Animal Diversity Assessment (p. 93-99). Springer Netherlands. (résumé)
- (citation de George James Allman (1856) in A monograph of the fresh-water polyzoa including all the known species, both British and foreign p. 75)
- « I have never met with Cristatella later than the autumn ; it seems to be strictly annual in its duration. »
- Annales des sciences naturelles comprenant la zoologie, la botanique, l'anatomie, et la physiologie comparée des deux règnes, et l'histoire des corps organisés fossiles, seconde série, Tome VII, imprimé chez Paul Renouard, Paris, 417 pages
- Turpin, Pierre Jean François, Étude microscopique de la Cristatella mucedo, Cuv., espèce de polype d'eau douce [Paris] impr. P. Renouard, s.d.
- Gervais MP (1837) Recherches sur les polypes d'eau douce des genres Plumatella, Cristatella et Paludicella, premier mémoire, synonymie des dives poylypes à panache, et description de la Cristatelle, communiqué à la société philomatique, le 4 mars 1837
- Turpin, M (1837) Étude microscopique de la Crsitatella mucedo, Cuv. espèces de polype d'eau douce. Lettre lue à l'Académie des sciences, dans sa séance du 9 janvier 1837
- Dictionnaire pittoresque d'Histoire naturelle et des phénomènes de la nature..., tome II, voir p. 394, 1835 (Paris, édité en plusieurs tomes de 1833 à 1840)
- (cité par George James Allman (1856) in A monograph of the fresh-water polyzoa including all the known species, both British and foreign, p. 77 & 78)
- Raspail (1828), Alcyonella, secundus evolutionis gradus ; Hist Nat. de l'Alcyon. Fluv. Mém. de la Soc. d'Hist. Nat. de paris, vol. iv, p. 129 (cité par George James Allman, Allman (1856) A monograph of the fresh-water polyzoa including all the known species, both British and foreign p. 77 & 78)
- Dalyell (1834 et 1848), Rare and Remarkable Animals of Scotland, vol ii (Original figures) Rp. Brit. Assoc., p. 604, et Edinb. New Phil Journ., vol xviii, p. 414 (cité par George James Allman Allman (1856) A monograph of the fresh-water polyzoa including all the known species, both British and foreign, p. 77 & 78)
- Gervais (1840) Diet. Sc. Nat. Suppl., art. Alcyonelle, Planches Supplémentaires, Pol. fluviatiles. (Original figures) ; cité par George James Allman Allman (1856) A monograph of the fresh-water polyzoa including all the known species, both British and foreign, p. 77 & 78)
- Karen Anna Økland, « Freshwater bryozoans (Bryozoa) of Norway: Distribution and ecology of Cristatella mucedo and Paludicella articulata », Mendeley.com,
- Species list of Albertas bryozoans on Aquatic Invertebrates of Alberta
- Reynolds JD (1976) . Occurrence of freshwater bryozoans, Cristatella mucedo-Cuvier, in British-Columbia ; Syesis, 9, 365-366.
- Hozawa, S. (1938). Cristatella mucedo Cuvier found in Japan. In A report which was made on the 14th Annual Meeting of the zoological Society of Japan of (p. 104).
- Notteghem, P. (2009). Évolution de la distribution de la Pectinatelle, Pectinatella magnifica (Leidy 1851), Bryozoaire d’eau douce, en France et en Europe. Rev Sci Bourgogne-Nature, 9-10
- Figuerola J, Green AJ, Michot TC (2005 ) “ Invertebrate eggs can fly: evidence of waterfowl-mediated gene flow in aquatic invertebrates”. Am Nat. 2005 Feb;165(2):274-80. Epub 2004 Nov 29 (résumé)
- Bilton, D. T., Freeland, J. R., & Okamura, B. (2001). Dispersal in freshwater invertebrates. Annual review of ecology and systematics, 159-181
- Wood, T. S. (2001) Freshwater bryozoans: a zoogeographical reassessment. Bryozoan studies, 2002, 339-345
- Okamura B, Jones CS, Noble LR. (1993) “Randomly amplified polymorphic DNA analysis of clonal population structure and geographic variation in a freshwater bryozoans” ; Proc Biol Sci. 1993 Aug 23; 253(1337):147-54.
- Jones CS, Okamura B, Noble LR (), “Parent and larval RAPD fingerprints reveal outcrossing in freshwater bryozoans” ; Mol Ecol. 1994 Jun; 3(3):193-9 (résumé)
- Freeland JR, Romualdi C, Okamura B (2000) « Gene flow and genetic diversity: a comparison of freshwater bryozoan populations in Europe and North America » ; Heredity (Edinb). novembre 2000; 85 Pt 5:498-508
- Freeland JR, Noble LR, Okamura B. (2000) « Genetic diversity of North American populations of Cristatella mucedo, inferred from microsatellite and mitochondrial DNA ». Mol Ecol. septembre 2000 ; 9(9):1375-89 (résumé).
- Joanna R Freeland, Chiara Romualdi, and Beth Okamura, « Gene flow and genetic diversity: a comparison of freshwater bryozoan populations in Europe and North America », Heredity,
- Økland, K. A., & Økland, J. (2000). Freshwater bryozoans (Bryozoa) of Norway: distribution and ecology of Cristatella mucedo and Paludicella articulata. Hydrobiologia, 421(1), 1-24 (résumé).
- Michiel van der Waaij (July 2009). "Freshwater bryozoans or moss animals". Microscopy-UK.org
- Les bryozoaires du Lac bleu, par l'ONG biosub-5962, consulté 2014-11-13
- Massard, J. A., & Geimer, G. (1991) Note sur les Bryozoaires d’eau douce trouvés en diverses stations luxembourgeoises et belges, avec des considérations sur la bryozoofaune de la Sûre et des remarques concernant les statoblastes de Hyalinella punctata (Hancock, 1850). Bull. Soc. nat. luxemb, 92, 131-148
- Michiel van der Waaij, « Freshwater bryozoans or moss animals », Microscopy-UK.org,
- Laura Uotila & Jukka Jokel, « Variation in reproductive characteristics of colonies of the freshwater bryozoan Cristatella mucedo », Onlinelibrary.wiley.com,
- Hengherr S, Schill RO (2011) Dormant stages in freshwater bryozoans--an adaptation to transcend environmental constraints. ; J Insect Physiol. Mai 2011;57(5):595-601. doi: 10.1016/j.jinsphys.2011.03.018. ; Epub, 1er mai 2011 (résumé)
- Schwaha T, Handschuh S, Redl E, Walzl MG () Organogenesis in the budding process of the freshwater bryozoan Cristatella mucedo Cuvier, 1798 (Bryozoa, Phylactolaemata) ; Journal of Morphology, mars 2011; 272(3):320-41. Epub 2010 Dec 10 (PDF, 117 pages)
- Gerwerzhagen, A. (1913). Beitrage zur Kenntnis der Bryozoen: I. Das Nervensystem von Cristatella mucedo cuv. Ruprecht-Karls-Universitat zu Heidelberg
- Staubesand J, Kersting KH (1965) [On the fine structure of the neurons of Bryozoa cristatella mucedo Cuv]. ; Verh Anat Ges. 1965;115:311-5. German. (pas de résumé disponible en ligne)
- Lützen, J., Jespersen, Å., & Nielsen, C. (2009). Ultrastructure of spermiogenesis in Cristatella mucedo Cuvier (Bryozoa: Phylactolaemata: Cristatellidae). Zoomorphology, 128(4), 275-283 (résumé)
- Okamura, B. (1997). The ecology of subdivided populations of a clonal freshwater bryozoan in southern England. Archiv für Hydrobiologie, 141(1), 13-34. (résumé Inist-CNRS)
- ex : Vidéo : Bryozoan endoparasite evolution, Natural History Museum, London, consulté 2014-09-20]
- Canning EU, Okamura B, Curry A. () “A New Microsporidium, Nosema cristatellae n. sp. in the Bryozoan Cristatella mucedo (Bryozoa, Phylactolaemata) » ; J Invertebr Pathol. 1997 Nov;70(3):177-83
- Hatton-Ellis TW, Noble LR, Okamura B (1998) « Genetic variation in a freshwater bryozoan. I: Populations in the Thames basin, UK” ; Mol Ecol. 1998 Nov; 7(11):1575-85 (résumé).
- Freeland JR, Jones CS, Noble LR, Okamura B (1999) Polymorphic microsatellite loci identified in the highly clonal freshwater bryozoan Cristatella mucedo ; . Mol Ecol. 1999 Feb; 8(2):341-2.
- Vernon JG, Okamura B, Jones CS, Noble LR (1996) « Temporal patterns of clonality and parasitism in a population of freshwater bryozoans ». Proc Biol Sci. 1996 Oct 22;263(1375):1313-8 (résumé)
- Anderson CL, Canning EU, Okamura B (1999) “Molecular data implicate bryozoans as hosts for PKX (phylum Myxozoa) and identify a clade of bryozoan parasites within the Myxozoa” ; parasitology. 1999 Dec;119 ( Pt 6):555-61
- Okamura B, Anderson CL, Longshaw M, Feist SW, Canning EU. (2001) « Patterns of occurrence and 18S rDNA sequence variation of PKX (Tetracapsula bryosalmonae), the causative agent of salmonid proliferative kidney disease » ; J Parasitol. 2001 Apr; 87(2):379-85.
- Kinkelin, P. D., & Gay, M. (2000). La tétracapsulose à Tetracapsula bryosalmonae: une bonne cible pour des études épidémiologiques en ichtyopathologie. Epidémiologie et santé animale, 38, 7-18.
- Kinkelin, P. D., & Gay, M.(2000 La tétracapsulose à Tetracapsula bryosalmonae: une bonne cible pour des études épidémiologiques en ichtyopathologie. Épidémiologie et santé animale, 38, 7-18
- La maladie et dite « Proliferative kidney disease » ou PKD : Hedrick R., McConnell E., de Kinkelin P (1993). "Proliferative kidney disease of salmonid fish". Annual Review of Fish Diseases 3: 277–290. doi:10.1016/0959-8030(93)90039-E
- morceaux de séquences du gène 18S rDNA de PKX
- Jiménez-Guri, E., Okamura, B., & Holland, P. W. (2007) Origin and evolution of a myxozoan worm. Integrative and comparative biology, 47(5), 752-758
- George James Allman, 1856A monograph of the fresh-water polyzoa including all the known species, both British and foreign
- Oda, S., & Mukai, H. (1985) Fine surface structure of the statoblasts of higher phylactolaemate bryozoans. Bryozoa: Ordovician to Recent. Olsen & Olsen, Fredensborg, Denmark, voir p. 233
- Freeland, J. R., Rimmer, V. K., & Okamura, B. (2001) Genetic changes within freshwater bryozoan populations suggest temporal gene flow from statoblast banks ; Limnology and oceanography, 46(5), 1121-1129
- Handschuh S, Schwaha T, Metscher B (2010). "Showing their true colors: a practical approach to volume rendering from serial sections. BMC Developmental Biology. DOI:10.1186/1471-213X-10-41. . PMC: 2876090 ou autre lien.