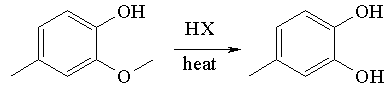Créosol
Le créosol (ou paracréosol) est un composé aromatique de formule C8H10O2, constitué d'un cycle de benzène, substitué par un groupe hydroxyle (phénol), un groupe méthoxyle et un groupe méthyle en positions 1, 2 et 4. Il peut être considéré comme un dérivé méthylé du gaïacol ou le dérivé méthoxylé du paracrésol. C'est un isomère de position de l'isocréosol qui ne diffère que par l'inversion de position des groupes hydroxyle et méthoxyle.
| Créosol | |

| |
| Identification | |
|---|---|
| Nom UICPA | 2-méthoxy-4-méthylphénol |
| Synonymes |
4-méthylgaïacol |
| No CAS | |
| No ECHA | 100.002.049 |
| No RTECS | GP1755000 |
| PubChem | 7144 |
| SMILES | |
| InChI | |
| Apparence | liquide jaune clair[1] à l'odeur épicée[2] |
| Propriétés chimiques | |
| Formule | C8H10O2 [Isomères] |
| Masse molaire[3] | 138,163 8 ± 0,007 7 g/mol C 69,54 %, H 7,3 %, O 23,16 %, |
| pKa | 10,28 à 25 °C[4] |
| Propriétés physiques | |
| T° fusion | 5 °C[1] |
| T° ébullition | 221 à 222 °C[1] |
| Solubilité | légèrement soluble dans l'eau[5], miscible avec l'éthanol, l'éther, le benzène, le chloroforme, l'acide acétique[6] |
| Masse volumique | 1,095 g·cm-3[1] |
| Point d’éclair | 99 °C (coupelle fermée)[1] |
| Propriétés optiques | |
| Indice de réfraction | 1,535-1,539[1] |
| Précautions | |
| SGH[1] | |
 |
|
| Écotoxicologie | |
| DL50 | 740 mg·kg-1 (rat, oral)[7] 76 mg·kg-1 (souris, i.v.)[8] |
| Unités du SI et CNTP, sauf indication contraire. | |
Occurrence
Le créosol est présent dans les goudrons de bois, en particulier le goudron de pin, et le créosote qui en est issu, mais on le trouve en plus grande quantité dans le bois de hêtre. Il est aussi présent, avec le gaïacol dans le produit de pyrolyse du gaïac et dans la résine de pin[9] - [10].
On le trouve également dans la gousse de vanille[11], le genévrier cade (Juniperus oxycedrus)[12], le tabac[13] et de nombreuses autres plantes[6].
Propriétés
Le créosol se présente sous la forme d'un liquide incolore à jaune, avec une odeur douce, épicée, rappelant le clou de girofle, avec une pointe de vanille et de cuir. Une solution plus diluée ajoute également un parfum de « fumé »[2]. Il serait d'ailleurs, avec le gaïacol, à l'origine du goût fumé de certains vins[14].
Le créosol est peu soluble dans l'eau[5], mais est miscible miscible avec l'éthanol, l'éther, le benzène, le chloroforme, l'acide acétique[6]. Son pKA est de 10,28[4], quasi identique à celui du paracrésol (10,26)[15], le groupe méthoxyle supplémentaire n'ayant donc quasiment pas d'influence sur ce paramètre.
Synthèse
Le créosol peut être produit par la réduction de la vanilline avec de la poudre de zinc et de l'acide chlorhydrique[16]. Il peut aussi être obtenu par dégradation thermique de l'acide férulique[17].
Utilisation
Le créosol est autorisé en additif alimentaire[18], comme agent de saveur et parfum. Il possède des propriétés antiseptiques et peut être utilisé comme désinfectant. Il est utilisé comme herbicide et comme agent de récurage dans les lessives[19]. Le créosol est un répulsif contre la mouche tsé-tsé[20].
Chimie
La réaction de clivage d'éther du créosol avec les halogénures d'hydrogène produit le 3,4-dihydroxytoluène.
L'action de la alcool vanillique oxydase permet de convertir le créosol en vanilline.
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Kreosol » (voir la liste des auteurs).
- Fiche Sigma-Aldrich du composé 2-Methoxy-4-methylphenol, consultée le 2 mai 2019.
- fiche 4-methyl guaiacol, the goodscents company
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche (en) « Créosol », sur ChemIDplus, consulté le 2 mai 2019.
- George A. Burdock, Encyclopedia of Food and Color Additives, CRC Press, , 3153 p. (ISBN 978-0-8493-9412-6, lire en ligne), p. 1697
- George A. Burdock: Fenaroli's Handbook of Flavor Ingredients. Sixth Edition. CRC Press, Boca Raton 2010, (ISBN 978-1-420-09086-4), p. 1198.
- Folia Medica Cracoviensia. Vol. 32, Pg. 309, 1991.
- Archives Internationales de Pharmacodynamie et de Thérapie. Vol. 164, Pg. 30, 1966.
- (de) Emil Abderhalden, Biochemisches Handlexikon., vol. 1, Springer-Verlag, (ISBN 978-3-642-51328-2), p. 645
- (de) Hermann von Fehling, Carl Hell, Carl Haeussermann, Karl Hugo Bauer, Neues Handwörterbuch der Chemie : auf Grundlage des von Liebig, Poggendorf und Wöhler, Kolbe und Fehling herausgegebenen Handwörterbuchs der reinen und angewandten Chemie, vol. 3, Brunswick, Vieweg, (DNB 560549326)
- (en) Daphna Havkin-Frenkel, Faith C. Belanger, Handbook of Vanilla Science and Technology, John Wiley & Sons, , 360 p. (ISBN 978-1-4443-2937-7, lire en ligne)
- (de) Marina Bährle-Rapp, Springer Lexikon Kosmetik und Körperpflege, Springer-Verlag, , 603 p. (ISBN 978-3-540-71095-0), p. 293
- (en) Alan Rodgman et Thomas A. Perfetti, The Chemical Components of Tobacco and Tobacco Smoke, CRC Press, (ISBN 978-1-4200-7884-8), p. 556
- (en) Kennison KR, Wilkinson KL, Williams HG, Smith JH, Gibberd MR, « Smoke-derived taint in wine: effect of postharvest smoke exposure of grapes on the chemical composition and sensory characteristics of wine », J Agric Food Chem, vol. 55(26), (PMID 18052239, DOI 10.1021/jf072509k)
- CRC Handbook of Tables for Organic Compound Identification. Third Edition, 1984, (ISBN 0-8493-0303-6).
- R. Schwarz, H. Hering, Creosol, Org. Synth. 33, coll. « vol. 4 », , p. 203
- (de) Hans-Dieter Belitz et Werner Grosch, Lehrbuch der Lebensmittelchemie, Springer-Verlag, , 862 p. (ISBN 978-3-662-08308-6, lire en ligne), p. 297
- OMS/FAO
- Ruth Winter, A Consumer's Dictionary of Household, Yard and Office Chemicals, iUniverse, , 349 p. (ISBN 978-0-595-44948-4, lire en ligne), p. 118
- (de) Wolfgang Legrum, Riechstoffe, zwischen Gestank und Duft : Vorkommen, Eigenschaften und Anwendung von Riechstoffen und deren Gemischen, Wiesbaden, Springer-Verlag, , 2e éd., 238 p. (ISBN 978-3-658-07310-7, lire en ligne), p. 67