Clayton Heathcock
Clayton Howell Heathcock Jr., né le à San Antonio (Texas)[1], est un chimiste américain reconnu pour ses nombreuses découvertes en chimie organique, notamment dans le domaine des végétaux et des cellules cancéreuses[2]. Il a reçu de nombreuses distinctions pour l’ensemble de son œuvre.

| Naissance | |
|---|---|
| Nationalité | |
| Domicile | |
| Formation | |
| Activités |
| A travaillé pour | |
|---|---|
| Membre de | |
| Distinction | Ernest Guenther Award, American Chemical Society (1986) |
Biographie
Issu de l’union entre Clayton Heathcock Senior et Frances Lay Heathcock, Clayton Heathcock a un frère, James Franklin Heathcock, et une sœur, Peggy Frances Heathcock, tous deux ses cadets[1]. Il a passé la majeure partie de son enfance à San Antonio dans une famille peu aisée[1].
Il a étudié au San Antonio Publics School à partir de 1958, puis a poursuivi ses études au Abilene Christian College en faisant un baccalauréat en sciences. Il a finalement terminé son parcours scolaire dans deux différentes universités : il a fait un doctorat en chimie organique en 1963 à l’Université du Colorado, puis un post doctorat de 1963 à 1964 à l’Université Columbia[3]. En terminant ses études, il alla travailler dans une usine spécialisée dans la fabrication de papier en tant que superviseur de laboratoire. Il devint ensuite enseignant. Il fut professeur de chimie et doyen du département de chimie de l’université de Californie à Berkeley. À ce jour, il est superviseur des recherches de l’université de Californie où ses étudiants poursuivent les recherches qu’il avait entamées[4].
Clayton Heathcock s’est marié à deux reprises. Son mariage avec sa première femme, Mable Ruth Sins, fut le 6 septembre 1957. Quatre enfants furent issus de cette union : Cheryl Linn en 1958, Barbara Sue en 1959, Steven Wayne en 1961 et Rebecca Ann en 1963. Clayton Heathcock et Mable Ruth Sins divorcèrent dix ans plus tard, en mars 1973. Il se maria ensuite à Chery Rae Hadley le 28 novembre 1980, puis divorça le 2 janvier 2015[4].
Distinctions et récompenses
Clayton Heathcock est un chimiste grandement récompensé. Il a notamment reçu le Ernest Guenther Award en 1986 par The American Chemical Society, le Allan R. Day Award en 1989 et en 1990, prix décerné par The Philadelphia Organic Chemists Club, puis le H. C. Brown Award en 2002, par The American Chemical Society également[3].
Travaux
Clayton Heathcock a consacré toute sa vie à la découverte de nouveaux modèles réactionnels afin de synthétiser diverses molécules. Les deux domaines où il a le plus investi de son temps sont ceux des médicaments anticancéreux ainsi que dans les composés naturels issus des végétaux[1].
Encore aujourd'hui, Clayton Heathcock continue de travailler en chimie organique, dans la recherche de composés affaiblissant ou arrêtant la croissance des cellules cancéreuses[1]. Ses élèves continuent et modifient le processus réactionnel débuté par leur professeur[4]. L'enjeu principal du médicament synthétisé par la réaction qu'à découvert Clayton Heathcock réside dans le fait que le rendement global est très faible : une très petite quantité de produit est obtenue pour une énorme quantité de molécules de Heathcock qu'il utilise en tant que substrat et réactifs. À ce jour, la production d'un composé anticancéreux nécessite plus de 100 étapes de réaction et donc de moyens financiers importants. L'enju et de trouver des réactions plus simples afin de synthétiser beaucoup de produits, pour passer à l'échelle industrielle, afin que le médicament soit accessible pour les oncologues et autres spécialistes du cancer[5]. Parmi les réactions étudiées à ce jour, il y a celle du taxol, un composé permettant d'inhiber la croissance de certains cancers, de l'acide zaragozique servant à titre de traitement contre le cancer et l'altohyrtine, composé ayant un potentiel anti-tumeur[2].
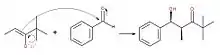
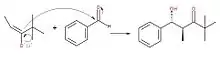
Heathcock a découvert plus de 50 réactions permettant la production de composés organiques s'apparentant à ceux des végétaux[5]. Celui-ci a été boursier à plusieurs reprises au nom de différentes organisations telles que le prix Herbert C. Brown[3] gagné grâce à l'originalité et la créativité dont il a fait preuve dans ses découvertes de synthèses : des réactions complexes faisant réagir des réactifs difficiles à manipuler menant à la production de produits naturels à plusieurs cycles. Parmi celles-ci, il est possible de retrouver la synthèse des alcaloïdes Daphniphyllum (en), molécules provenant d'une sorte d'arbre particulier, ainsi qu'une modification du mécanisme de l'aldolisation[2]. Ce dernier est l'un de ses plus importants et est régi par un déplacement de l'équilibre chimique qui favorise grandement la production d'aldol.
Ce mécanisme doit débuter seulement lorsque le réactif est transformé en énolate. Il s'agit d'une étape préliminaire où la base mise en solution va réagir avec l'hydrogène du carbone en alpha du réactif choisi, dans ce cas-ci l'acétone. Puisqu'un des carbones en bout de chaîne devient négatif, une réorganisation se fait par mésomérie et permet de déplacer le lien π vers le carbone devenu négatif. De cette façon, l'oxygène devient négatif à son tour et permet de stabiliser le carbone.
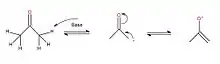
Par la suite, le mécanisme réactionnel peut commencer. Il y aura premièrement une délocalisation de la charge de l'oxygène donnant à l'énolate un caractère nucléophile afin que celui-ci puisse attaquer le carbonyle électrophile pour créer une liaison carbone-carbone. De plus, le lien π revient à l'oxygène afin de respecter la règle de l'octet.
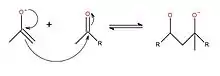
La troisième étape consiste à neutraliser le produit formé à l'aide de la base protonnée à l'étape 1 : l'oxygène négatif, qui donne le caractère basique à la molécule, va attaquer l'hydrogène de la base protonnée. Ceci permettra donc d'incorporer une fonction alcool à la molécule.
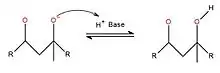
Dépendamment du composé recherché, il est possible d'arrêter la réaction à cette étape, afin d'avoir un aldol, ou encore de la poursuivre afin de déshydrater ce dernier, donc de faire une crotonisation, réaction qui contrairement à toutes les autres, est irréversible. En fait, en ajoutant une base à la solution, cette dernière viendra attaquer l'hydrogène du carbone médian afin de lui laisser une charge négative. Puis par résonance, l'alcool sera éjecté à la suite de la création d'un lien double sur la molécule[6].
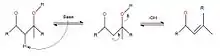
De cette façon, la réaction est maintenant complète et le produit final est celui désiré, soit un carbonyle α-β-insaturé. Il est à noter que cette réaction peut se faire aussi bien avec un aldéhyde qu'une cétone.
Son apport à la connaissance de ce mécanisme consiste à relever que, dépendamment de la configuration de l'énolate de départ, soit Z ou E, les produits formés seront différents. Effectivement, lorsque la configuration Z est employée, le produit obtenu sera majoritairement un aldol Syn (érythro), tandis que l'utilisation de la configuration E produira de l'anti-β-hydroxycarbonyle (thréo). Il y a donc différentes molécules produites dépendamment des isomères géométriques utilisés. Ces deux produits peuvent avoir des caractéristiques physiques qui diffèrent, ainsi qu'une stabilité contrastante, c'est-à-dire que la molécule obtenue par l'énolate E sera beaucoup plus stable vu l'encombrement stérique moindre. Dans certaines conditions, il est également possible que l'énergie cinétique de réaction soit plus basse, et donc, la création de produits pour l'isomère Z est facilitée.
En fait, la réaction reste principalement la même pour obtenir les deux produits. La différence réside dans l'angle d'attaque des électrons ou de la charge négative. Il y a d'abord un refoulement d'électrons de l'oxygène aux prises avec une charge négative, puis une attaque de l'insaturation sur le carbonyle. L'oxygène de ce dernier obtiendra alors une charge négative et, par protonation, formera un groupement alcool[7].
Références
- (en) Clayton Howell Heathcock Jr., « About the Author; Clayton Howell Heathcock, Jr. » (consulté le ).
- (en) Clayton H. Heathcock, « Nature knows best : An amazing reaction cascade is uncovered by design and discovery » (consulté le ).
- (en) « Recent Award Winners: Clayton Heathcock and T. Don Tillet Win American Chemical Society Awards », sur ChemiCALScience and Engineering News (consulté le ).
- (en) « Genealogy – Person Sheet » (consulté le ).
- (en) « Faculty Profile : Clayton Heathcock », sur The News Journal (consulté le ).
- « 5 minutes pour comprendre – L'aldolisation – UE1 », sur Youtube (consulté le ).
- (en) M.R. Luzung, « Clayton H. Heathcock », (consulté le ).