Chalara fraxinea
Hymenoscyphus fraxineus

Chalara fraxinea est une espèce de champignons pathogènes, responsable d'une maladie fongique (phytopathologie) dite « chalarose » ou « maladie du flétrissement du frêne ». Cette maladie émergente apparue en Pologne puis en Lituanie[2] au début des années 1990 s'étend rapidement[3] en Europe depuis le début du XXIe siècle ; elle touche deux espèces de frênes : Fraxinus excelsior et Fraxinus angustifolia.


(sur un frêne de 5 ans)
Sa forme téléomorphe (sexuée) a d'abord été prise en 2009 pour Hymenoscyphus albidus par Kowalski et Holdenrieder (2009)[4] (un petit champignon non pathogène, décrit par Desmazières (1851), qui l'a découvert près de Caen avant qu'il soit occasionnellement trouvé un peu partout en Europe, fructifiant sur des pétioles de feuilles de frêne tombées au sol[2]). Cette forme téléomorphe est aujourd'hui attribuée à une espèce proche, morphologiquement identique : Hymenoscyphus pseudoalbidus[2] ou Hymenoscyphus fraxineus (Baral et al., 2014) et décrite sous le nom Chalara fraxinea pour sa forme asexuée (anamorphe) (décrite en 2006 par Kowalski).
« La rapidité de progression de la maladie et son mode de dispersion ne permettent pas d’envisager des mesures d’éradication »[2].
La chalarose
C'est le nom de la maladie causée chez certains frênes par le champignon ascomycète Chalara fraxinea, qui peut attaquer le frêne à tous les âges et qui a été détecté par l'INRA sur toutes les parties possibles de l'arbre malade (collet, houppier, racines, pousses, gourmands), mais toujours uniquement au niveau des nécroses ou des pourritures, et non dans le bois sain (aubier, bois de cœur).
Si ceci est confirmé par d'autres observations, on pourrait en déduire que la qualité de la grume n'est pas affectée (hors zones de nécrose ou pourriture)[5] ; Cependant faire circuler des bois issus d'arbres malades, pour les besoins d'industrie ou de chauffage ou autres usages, pourrait contribuer à la diffusion de spores contaminantes, bien que ceci n'ait pour l'instant jamais été démontré [5].
Une étude suédoise sur des frênes malades[6] a trouvé ce champignon associé à d'autres espèces (Gibberella avenacea, Alternaria alternata, Epicoccum nigrum, Botryosphaeria stevensii, Valsa sp., Lewia sp., Aureobasidium pullulans et Phomopsis sp.). Ces champignons ont été inoculés à de jeunes frênes sains, et après 2 ans, seules 4 espèces (A. alternata, E. nigrum, C. fraxinea et Phomopsis sp.) ont conduit à l'observation de nécroses de l'écorce et du cambium typiques de la maladie. C. fraxinea présentait le pouvoir pathogène le plus élevé : il s'est développé chez environ la moitié des arbres inoculés, alors que les autres espèces de champignon n'ont causé de nécroses que chez 3 à 17 % des frênes inoculés.
La biologie de C. fraxinea et les éventuelles causes environnementales d'une susceptibilité aggravée de F. excelsior sont encore mal comprises et doivent faire l'objet de nouvelles études[6] - [7]. Toutefois, on sait que la maladie a une sévérité particulièrement forte dans les sites très humides (Husson et al, 2012, Marçais et al, 2016)
Hypothèse à confirmer : des métabolites secondaires découvertes en laboratoire (Grad et al., 2009) dont une la viridine (mycotoxique) et le viridiol (phytotoxine) pourraient synergiquement combiner leurs effets, respectivement en protégeant H. pseudoalbidus de la concurrence d'autres champignons à croissance plus rapide (selon Kowalski et Bartnik, 2010)[8] et provoquer les nécroses foliaires observées sur les arbres malades (selon Andersson et al., 2010[9]).
Espèces touchées : Entre 2000 et 2010, des frênes non-européens (nord-américains principalement) introduits ont été retrouvés porteurs de symptômes de la maladie dont Fraxinus nigra qui y semble très vulnérable, Fraxinus pennsylvanica apparemment moins sensible, et Fraxinus americana et Fraxinus mandschurica a priori rarement touchés[10].
Prévalence géographique
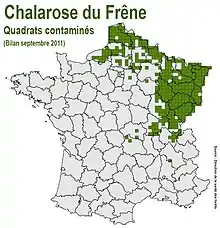
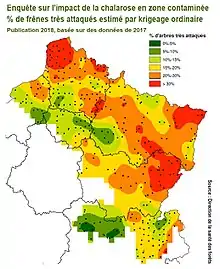
En Europe la chalarose est apparue en Pologne au début des années 1990 avant de s'étendre en Europe septentrionale, centrale et du sud[6].
La répartition de la maladie est encore mal connue, mais fait l'objet d'un suivi dans de nombreux pays, dont la France avec l'INRA et le DSF.
En Belgique, il fait l'objet d'un suivi sanitaire par la Région wallonne depuis 2009. Cette année-là, il n'a pas été détecté, mais en 2010, de premiers sites infectés ont été repérés[11]. Des mesures d’éradication ont cherché, sans succès à stopper la propagation de la maladie[12] - [13].
En France, où le frêne commun est localement une essence très importante et où il est très présent dans les haies, on estime qu'il y a vers 2015 environ 1,4 million d'hectares peuplés à plus de 75 % de frêne (9 % environ de la superface boisée, soit 21 millions de m3 de bois d’œuvre potentiels selon l'IGN, surtout concentrés dans le quart nord-est de l’hexagone où la chalarose est présente depuis plusieurs années. Les dépérissements sont surveillés par le Département Santé des forêts du ministère de l'agriculture, les premiers symptômes ont été signalés dans la Haute-Saône en 2008 et la maladie s'étend depuis.
En 2009, elle était signalé dans le Pas-de-Calais, à Lugy, près de Fruges. En 2010, onze départements étaient déclarés touchés, avec plusieurs foyers signalés dans le nord de la France (Pas-de-Calais notamment où néanmoins - en 2009 - l'État recommandait de ne pas changer les pratiques d'exploitation[14]) et dans l'est (Alsace, presque partout). En 2011, la totalité du Nord Pas-de-Calais était considérée comme touchée et deux départements proches, (Aisne et Oise) étaient jugés en situation préoccupante. En 2014-15 la maladie atteint l'ensemble de la Normandie, de la Beauce, du nord du massif Central et des Alpes. En 2015, un nouveau foyer est détecté dans les Charentes, aux environs de Jarnac. La mortalité reste faible chez les arbres adultes, mais élevée chez les jeunes peuplements (comme pour les chancres bactériens). On suggère que les tirs, notamment à la grenaille, chevrotine notamment, blessant les jeunes arbres en milieux forestiers, offrent des portes d'accès au cambium, augmentant la vitesse d'expansion des pathogènes dans certains secteurs. La croissance est souvent réduite et le pourcentage d'arbres adultes porteurs de symptômes peut dépasser 80 % des frênes des massifs suivis. En 2018 une cartographie a été publiée, basée sur une évaluation de 2017 faite sur 35 départements déjà contaminés sur la base d'un protocole précis (une frênaie évaluée par quadrat de 16 km où le frêne est très présent ou d'importance économique selon l'IGN).
https://agriculture.gouv.fr/avancee-de-la-chalarose-sur-le-territoire
Origine du champignon
Une étude menée à l'INRA a montré le caractère exotique et invasif de l'agent pathogène[15]. Puis il a été montré que C. fraxinea est très probablement d'origine asiatique où il a été détecté sur des frênes indigènes, F. mandshurica, au Japon, et où la diversité génétique du pathogène est beaucoup plus élevée qu'en Europe[16].

L’analyse génétique des deux espèces proches laisse penser qu'elles n'ont pas d’ancêtres communs récents [17], ce qui laisse penser qu'il s'agit d'une espèce introduite et devenue invasive. Son origine a été trouvée et se trouve en Asie du Sud-Est.

Certaines pratiques devraient être surveillées quant à la propagation rapide de cette maladie
Résistance génétique chez les frênes
Une étude danoise (2007 à 2009, publiée en 2012[18]) a montré que les clones de frênes (parmi une trentaine de clones différents testés) réagissent différemment à cette maladie : tous les clones infectés ont présenté des symptômes, mais avec de fortes variations. Le degré de sensibilité des clones était fortement corrélé à la sénescence des feuilles en automne (plus précoce chez les clones plus sains). L'étude a montré une résistance d'origine génétique chez certains clones, associée à cette chute plus précoce des feuilles[18]. De façon générale, plusieurs études confirment qu'il existe de la variabilité génétique héritable dans la résistance à la maladie dans les populations de F. excelsior, allant des plus résistants (moins de 5 % de la population de frênes) aux très sensibles qui disparaîtront rapidement[19] - [20] - [21]. La chalarose aura un impact économique majeur ainsi qu'un fort impact écologique sans toutefois remettre en cause la préservation de l'espèce. Les clones les plus résistants freinent la propagation du champignon[18].
Si le champignon ne contourne pas cette résistance, la sylviculture pourrait utiliser certains de ces clones[18].
Symptômes
- Flétrissement de rameaux.
- Dessèchement de l'écorce qui devient localement orangée et qui peut cacher la présence de scolytes (Hylésine du fresne Leperesinus fraxini et/ou l'hylésine crénelé Hylesinus crenatus lors de certaines observations faites en France[5] en Haute-Saône).
- Mort des pousses.
- Descente de cime avec en réaction apparition de nombreux gourmands, eux-mêmes souvent mycosés.
- Fréquentes nécroses corticales à la base des rameaux tués par le champignon, pouvant gagner toute la branche avec des faciès chancreux.
- Des lésions au collet sont aussi fréquemment mentionnées. Elles peuvent précéder les symptômes de houppier sur un arbre. L'armillaire, agent pathogène ne pouvant attaquer que les frênes affaiblis sur-infecte rapidement les lésions induites par H. fraxineus. aggravant la ceinturation du collet. Ce champignon est aussi un agent de pourriture de bois très actif et induit un risque de casse de l'arbre élevé.
Ce champignon a fait l'objet d'une alerte internationale de l'EPPO et sa présence peut être maintenant diagnostiquée par PCR (plus rapidement qu'en isolant le champignon sur gélose) par certains laboratoires[6] - [22]. Cette technique devrait faciliter la recherche du champignon et l'acquisition de données d'intérêt éco-épidémiologique[22].
 Symptômes foliaires
Symptômes foliaires Petite lésion sur écorce
Petite lésion sur écorce lésion linéaire le long d'une branche
lésion linéaire le long d'une branche
Culture en laboratoire
Chalara fraxinea ne croît que très lentement sur les supports classiques de gélose, alors qu'il se développe très vite chez les frênes infectés (pour ceux qui n'y résistent pas naturellement)[22].
Exploitation du bois
En France, le ministère de l'Agriculture déconseille le martelage tardif fin août. En effet, les frênes atteints de chalarose perdent souvent leurs feuilles précocement et peuvent être totalement défeuillés dès le 15 août, entraînant une mauvaise appréciation de l'état sanitaire de l'arbre. Il est recommandé de n'exploiter que des arbres ayant plus de 50 % du houppier dépérissant. En effet, un des buts importants de la gestion des frênaies atteintes de chalarose est de permettre la régénération des frênes résistants. Il est donc déconseillé d'exploiter de façon trop sévère les peuplements atteints.
Voir aussi
Articles connexes
- Phytopathologie
- Frêne
- Office national des forêts
- Département de la santé des forêts
Liens externes
- (fr) Le site thématique de l'INRA consacré au frêne et à la chalarose : fraxinus.fr
- Le site du projet chalfrax sur la gestion des frênaies françaises menacées par la chalarose : https://chalfrax.cnpf.fr/ (fr)
- (fr) Référence Catalogue of Life : Chalara fraxinea T. Kowalski 2006 Non Valide (consulté le )
- (fr) Référence Catalogue of Life : Hymenoscyphus pseudoalbidus Queloz, Grünig, Berndt, T. Kowalski, T.N. Sieber & Holdenr. 2011 (consulté le )
- (en) Référence Index Fungorum : Chalara fraxinea T. Kowalski 2006 Non valide (+ MycoBank) (consulté le )
- (en) Référence Index Fungorum : Hymenoscyphus pseudoalbidus Queloz, Grünig, Berndt, T. Kowalski, T.N. Sieber & Holdenr. 2011 (+ MycoBank) (consulté le )
- (en) Référence MycoBank : Chalara fraxinea T. Kowalski (consulté le )
- (en) Référence NCBI : Hymenoscyphus pseudoalbidus (taxons inclus) (consulté le )
- (fr) Plaquette de présentation, Ministère français de l'agriculture
Bibliographie
- (fr) Ministère de l'Agriculture, Les symptômes de la chalarose
- (fr) Ministère de l'Agriculture, La chalarose
- (fr) Ministère de l'Agriculture, Carte d'évolution de la chalarose
- (fr) Note de Service DGAL/SDQPV/N2009-8315 et sur le site du Ministère de l’agriculture (dans la rubrique Santé et protection des végétaux/Santé des forêts)
- (fr) Husson, C., Dowkiw, A., Saintonge, F. X., & Marcais, B. (2016). La chalarose du frêne en France. Forêt Entreprise, (228), 10-13.
- Le frêne face à la chalarose, Paris, Centre national de la propriété forestière, , 328 p. (ISBN 978-2-916525-65-5).
- (en) Bakys R, Vasaitis R, Barklund P, Ihrmark K, Stenlid J (2009) Investigations concerning the role of Chalara fraxinea in declining Fraxinus excelsior. Plant Pathology, 58, , pp. 284–292
- (en) Bakys R, Vasaitis R, Barklund P, Thomsen I.M, Stenlid J (2009). Occurrence and pathogenicity of fungi in necrotic and non-symptomatic shoots of declining common ash (Fraxinus excelsior) in Sweden. European Journal of Forest Research, 128, , pp. 51–60.
- (en) Bakys R, Vasiliauskas A, Ihrmark K, Stenlid J, Menkis A, Vasaitis R. (2011) Root rot, associated fungi and their impact on health condition of declining Fraxinus excelsior stands in Lithuania. — Scandinavian Journal of Forest Research, 26, , pp. 128–135.
- (fr) Gauquelin (coordinateur) et al, Guide de gestion des forêts en crise sanitaire, 2010 ed. ONF/IDF - 2011, 96 p. 2011-01-24 (Présentation et commentaires. Voir aussi (du même auteur) à propos de la gestion des dépérissements)
- (fr) E. Paillassa, Ph. Riou-Nivert, J. Rosa, Guide de l’expérimentation forestière en liaison avec le changement climatique ; IDF, 2012, 224 pp.
- (fr) Christophe Drenou, Vitalité et solidité de l'arbre : choisir les méthodes de diagnostic, IDF
- (en) Rosenvald, Raul, Rein Drenkhan, Taavi Riit, and Asko Lõhmus (2015) "Towards silvicultural mitigation of the European ash (Fraxinus excelsior) dieback: the importance of acclimated trees in retention forestry." Canadian Journal Of Forest Research 45, no. 9: 1206-1214.
Références
- Catalogue of Life Checklist, consulté le 18 août 2013
- Morgane Goudet – Dominique Piou (2012) La Chalarose du Frêne : que sait-on ? , Rev. For. Fr. LXIV - 1-2012
- GOUDET (M.), IOOS (R.), GRANDJEAN ( J.-P.). — Chalara fraxinea, quelles évolutions depuis 2008 ? — Forêt- Entreprise, 2011, pp. 11-13.
- KOWALSKI T & , HOLDENRIEDER O (2009), The teleomorph of Chalara fraxinea, the causal agent of ash dieback. Forest Pathology, 39, 304
- Ministère de l'Agriculture, Les symptômes de la chalarose ; 2008
- Renaud Ioos, Tadeusz Kowalski, Claude Husson and Ottmar Holdenrieder ; Rapid in planta detection of Chalara fraxinea by a real-time PCR assay using a dual-labelled probe : European Journal of Plant Pathology Volume 125, Number 2, 329-335, on line : 22 avril 2009, DOI: 10.1007/s10658-009-9471-x
- Remigijus Bakys, Rimvydas Vasaitis, Pia Barklund, Iben M. Thomsen and Jan Stenlid Occurrence and pathogenicity of fungi in necrotic and non-symptomatic shoots of declining common ash (Fraxinus excelsior) in Sweden ; European Journal of Forest Research Volume 128, Number 1, 51-60, DOI: 10.1007/s10342-008-0238-2 (Résumé)
- KOWALSKI (T.), BARTNIK (C.). — Morphological variation in colonies of Chalara fraxinea isolated from ash(Fraxinus excelsior L.) stems with symptoms of dieback and effects of temperature on colony growth andstructure. — Acta Agrobotanica, 63, 2010, pp. 99-106
- ANDERSSON (P.F.), JOHANSSON (S.B.K.), STENLID ( J.), BROBERG (A.). — Isolation, identification and necrotic activity of viridiol from Chalara fraxinea, the fungus responsible for dieback of ash. — Forest Pathology, 40, 2010, pp. 43-46
- DRENKHAN R & HANSO M (2010) ; New host species for Chalara fraxinea. New Disease Reports, 22, p. 16.
- Actualités - 1er juillet 2013 sur le site de l'Office économique wallon du bois
- Article de Forêt wallonne.
- Un champignon menace les frênes wallons de disparition, rtbf.be, 11 septembre 2014
- DRAF (Direction Régionale de l'Alimentation, de l’Agriculture et de la Forêt) ; Évolution de la chalarose sur frêne.
- Husson, C., Scala, B., Caël, O., Frey, P., Feau, N., Ioos, R., Marçais, B. 2011. Chalara fraxinea is an invasive pathogen in France. Forest Pathology 130:311-324
- Zhao et al. 2012. Hymenoscyphus pseudoalbidus, the correct name of Lambertella albida reported from Japan. Mycotaxon 122:25-41.
- BENGTSSON (S.B.K.), VASAITISA (R.), KIRISITS (T.), SOLHEIM (H.), STENLID (J.) Population structure of Hymenoscyphus pseudoalbidus and its genetic relationship to Hymenoscyphus albidus | Fungal Ecology, 5, 2012, pp. 147-153.
- McKinney L.V., Thomsen I.M., Kjaer E.D., Nielsen L.R. [2012]. Genetic résistance to Hymenoscyphus pseudoalbidus limits fungal growth and symptom occurrence in Fraxinus Excelsior. Forest Pathology 42 : 69-74 (6 p., 2 fig., 2 tab., 20 réf.).
- Kjær et al. 2012. Adaptive potential of ash (Fraxinus excelsior) populations against the novel emerging pathogen Hymenoscyphus pseudoalbidus. Evol. Appl. 5: 219–228.
- Mc Kinney et al. 2011. Presence of natural genetic resistance in Fraxinus excelsior (Oleraceae) to Chalara fraxinea (Ascomycota): an emerging infectious disease. Heredity 106: 788-797
- Pliura A. et al. 2011. Performance of twenty four European Fraxinus excelsior populations in three Lithuanian progeny trials with a special emphasis on resistance to Chalara fraxinea. Baltic For. 17: 17–34
- Renaud Ioos, Tadeusz Kowalski, Claude Husson and Ottmar Holdenrieder ; Rapid in planta detection of Chalara fraxinea by a real-time PCR assay using a dual-labelled probe ; European Journal of Plant Pathology Volume 125, Number 2, 329-335, DOI: 10.1007/s10658-009-9471-x (Résumé)