Carbure de béryllium
Le carbure de béryllium est un composé chimique de formule Be2C. Il se présente comme un solde rouge très dur cristallisé dans le système réticulaire cubique. Il réagit lentement au contact de l'eau pour former de l'hydroxyde de béryllium Be(OH)2 et du méthane CH4[4] :
| Carbure de béryllium | |
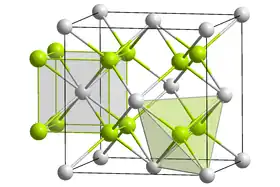
| |
| __ Be2+ __ C4− | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.007.319 |
| No CE | 208-050-7 |
| PubChem | 68173 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | Be2C |
| Masse molaire[1] | 30,035 1 ± 0,000 8 g/mol C 39,99 %, Be 60,01 %, |
| Propriétés physiques | |
| T° fusion | > 2 100 °C[2] |
| Masse volumique | 1,9 g·cm-3[2] |
| Précautions | |
| SGH[3] | |
   Danger |
|
| Transport[3] | |
| Unités du SI et CNTP, sauf indication contraire. | |
L'hydroxyde de béryllium étant amphotère, la réaction est accélérée en présence d'hydroxydes alcalins pour former des béryllates solubles dans l'eau :
Le fluor, le chlore et le brome réagissent avec le carbure de béryllium pour donner l'halogénure de béryllium correspondant formant du noir de carbone[4] :
Le carbure de béryllium peut être obtenu par réaction directe des éléments entre eux[2] : la réaction exothermique commence à 900 °C, chauffant le milieu réactionnel jusqu'à 1 400 °C[5] :
Il est également possible de réduire de l'oxyde de béryllium BeO avec du carbone à haute température pour former du carbure de béryllium en libérant de l'oxygène[4] :
À plus haute température, la réaction libère du monoxyde de carbone CO :
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Dale L. Perry et Sidney L. Phillips, Handbook of inorganic compounds, 1995, CRC Press, p. 62, (ISBN 978-0-8493-8671-8).
- Entrée « Beryllium compounds » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 1 août 2017 (JavaScript nécessaire)
- (en) Philip E. Browning, « The Chemistry and Literature of Beryllium », Journal of the American Chemical Society, vol. 31, no 6, , p. 724-725 (DOI 10.1021/ja01936a017, lire en ligne)
- (en) Kenneth A. Walsh, Beryllium chemistry and Processing, 2009, ASM International, p. 117, (ISBN 978-0-87170-721-5).
