Carborane
Un carborane est une molécule constituée d'atomes de bore et de carbone. Comme beaucoup de boranes, les carboranes sont polyédriques. Ils sont classifiés comme closo-, nido-, arachno-, hypho-, etc. carboranes suivant qu'ils représentent un polyèdre complet (closo-), ou un polyèdre ayant perdu un (nido-), deux ou trois (arachno-), ou plusieurs sommets (hypho-).
Historique

La synthèse et l'étude des carboranes font suite à la compréhension de la structure des boranes.
Avant l'étude par diffraction des RX dans les années 1950-60, les boranes et par extension les carboranes étaient vus comme des cycles ou des chaînes pseudo-hydrocarbures. Lipscomb élucida le premier les structures de B4H10, B5H9, B5H11, B6H10, B8H12 et B9H15 liquides volatils à température ambiante à l'aide de vapeur froide d'azote liquide et même d'hélium (−165 °C) pour B2H6[1].
Les premiers efforts pour appliquer le modèle de liaison des hydrocarbures aux boranes furent bloqués par le caractère "électron déficient" du bore, avec ses 3 électrons de valence contre 4 pour le carbone. La solution a été trouvée par l'étude du diborane (H3B-BH3), équivalent éthane (H3C-CH3) du bore possédant 12 électrons de valence alors que l'hydrocarbure en nécessite 14. La géométrie réelle contient 4 B-H terminaux et 2 ponts à trois centres B-H-B. Cette structure est analogue non pas à l'éthane mais à l'éthylène (CH2=CH2) avec laquelle elle est isoélectronique; en fait, la paire de ponts B-H-B peut être vue comme une « liaison double protonée ». Ainsi, toutes les orbitales liantes sont occupées dans B2H6 comme dans C2H4 et il n'y a pas d'électron déficient dans chacun des deux composés.
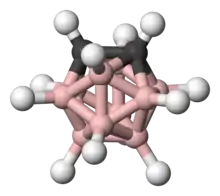
L'ortho-carborane
Un exemple remarquable est la molécule neutre o-carborane (C2B10H12) avec le préfixe o dérivé d'ortho, qui a été étudié pour son utilisation dans une large variété d'applications des polymères thermorésistants aux applications médicales. Ce composé est appelé super aromatique parce qu'il répond à la règle de Hückel et présente une haute stabilité thermique. À 420 °C, l'o-carborane est converti en son isomère méta-. En comparaison, le benzène requiert une température >1 000 °C pour induire un réarrangement du squelette. Comme les arènes, les carboranes sont sujets aux substitutions électrophiles aromatiques.
L'acide carborane
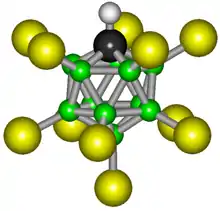
Des chercheurs de l'université de Californie, à Riverside, et de l'Institut Boreskov de Novossibirsk (Russie) ont synthétisé un acide dont l'anion est un carborane. Cet acide, extrêmement stable, est le troisième plus fort connu après l'acide fluoroantimonique HSbF6, au minimum un million de fois plus fort que l'acide sulfurique concentré (H2SO4) et cent fois plus fort que l'acide fluorosulfurique (HFSO3), beaucoup plus corrosif (The Strongest Isolable Acid, Angewandte Chemie). Il est donc classé dans la catégorie des superacides.
Ils sont construits sur un arrangement icosaédrique de onze atomes de bore et un atome de carbone : CB11H12−. Cette structure et l'anion CB11HCl11− étant particulièrement stables, le carborane n'est pas corrosif comme le sont les ions fluorure ou chlorure de l'acide fluorhydrique ou de l'acide chlorhydrique. Ce sont également les seuls acides connus capables de protoner le buckminsterfullerène C60 sans le décomposer. Les anions carboranes peuvent complexer les ions métalliques, ce qui en fait de bons catalyseurs, par exemple pour les réactions d'hydrogénation.
Synthèse
Le carborane C2B10H12 peut être synthétisé par réaction entre le décaborane et le diéthyl-sulfure :
- B10H14 + 2 (CH3CH2)2S → B10H12((CH3CH2)2S)2 + H2
- B10H12((CH3CH2)2S)2 + C2H2 → C2B10H12 + (CH3CH2)2S + H2
Atoxique et non-corrosif, l'acide carborane pourrait être utilisé pour la fabrication de polymères thermorésistants ou dans des applications médicales.
Références
- A. Cotton, G. Wilkinson, C.A. Murrilo and M. Banchmann, Advanced Inorganic Chemistry, 6th ed., 1999, John Wiley & Sons, Inc., New York