Acide fluoroantimonique
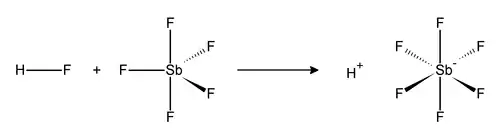
L’acide fluoroantimonique est un mélange en proportions variables de fluorure d'hydrogène et de pentafluorure d'antimoine[3]. La combinaison 1:1 de ce mélange, de formule chimique HSbF6, correspond au superacide connu le plus fort, capable de protoner même des hydrocarbures en carbocations[4].
| Acide fluoroantimonique | |||
| |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | acide fluoroantimonique | ||
| Synonymes |
acide hexafluoroantimonique. |
||
| No CAS | |||
| No ECHA | 100.037.279 | ||
| No CE | 241-023-8 | ||
| PubChem | 6337100 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide visqueux incolore | ||
| Propriétés chimiques | |||
| Formule | HSbF6 | ||
| Masse molaire[1] | 236,758 ± 0,001 g/mol H 0,43 %, F 48,15 %, Sb 51,43 %, |
||
| pKa | -25 à -30 selon les auteurs | ||
| Propriétés physiques | |||
| T° ébullition | décomposition | ||
| Solubilité | décomposition | ||
| Précautions | |||
| SGH[2] | |||
   Attention |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
La réaction du fluorure d'hydrogène HF et du pentafluorure d'antimoine SbF5 est exothermique. HF libère l'ion H+ et sa base conjuguée F− est séquestrée par un ou plusieurs SbF5 pour conduire à l'ion octaédrique [SbF6]−. Cet anion est non coordinant dans la mesure où il est à la fois très faiblement nucléophile et très faiblement basique.
Le proton de l'ion H+ du système HF + SbF5 à 1:1 est presque totalement libre, ce qui explique son acidité extrême : l'acide fluoroantimonique HSbF6 est 2 × 1019 fois plus fort que l'acide sulfurique H2SO4 à 100 %.
Cet acide est si fort qu'il peut protoner pratiquement n'importe quel composé organique. Bickel et Hogeveen ont montré en 1967 qu'un mélange équimolaire HF + SbF5 libère H2 à partir d'isobutane HC(CH3)3 et CH4 à partir de néopentane C(CH3)4[5] - [6] :
Deux composés obtenus à partir de mélanges HF + SbF5 ont été cristallisés et analysés par diffractométrie de rayons X. Il s'agit des sels [H2F+][Sb2F11−] et [H3F2+][Sb2F11−], dont l'anion est [Sb2F11−][7], la structure duquel a ainsi pu être déterminée.
L'acide fluoroantimonique est décomposé de façon explosive par l'eau et réagit avec pratiquement tous les solvants[4], hormis le fluorure de chlorosulfonyle SO2ClF et le dioxyde de soufre SO2, ainsi que les chlorofluorocarbones.
Il doit être stocké dans des récipients en polytétrafluoroéthylène (PTFE).
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Hydrogen Fluoride–Antimony(V) Fluoride », e-EROS Encyclopedia of Reagents for Organic Synthesis, 2004.
- (en) George Andrew Olah, « A life of magic chemistry: autobiographical reflections of a nobel prize winner », John Wiley and Sons, 2001, p. 100–101. (ISBN 978-0-471-15743-4).
- (en) H. Hogeveen et A. F. Bickel, « Chemistry and spectroscopy in strongly acidic solutions: electrophilic substitution at alkane-carbon by protons », Chemical Communications (London), no 13, , p. 635-636 (DOI 10.1039/C19670000635, lire en ligne).
- (en) A. F. Bickel, C. J. Gaasbeek, H. Hogeveen, J. M. Oelderik et J. C. Platteeuw, « Chemistry and spectroscopy in strongly acidic solutions: reversible reaction between aliphatic carbonium ions and hydrogen », Chemical Communications (London), no 13, , p. 634-635 (DOI 10.1039/C19670000634, lire en ligne).
- (en) Dietrich Mootz, Klemens Bartmann, « The Fluoronium Ions H2F⊕ and H3F⊕2: Characterization by Crystal Structure Analysis », Angewandte Chemie – International Edition in English, vol. 27, no 3, , p. 391-392 (DOI 10.1002/anie.198803911, lire en ligne).