Acide magique
L’acide magique est un superacide de formule HSO3F·SbF5 et de pKa voisin de −20 résultant du mélange équimolaire d'acide fluorosulfurique HSO3F et de pentafluorure d'antimoine SbF5. On l'appelle « magique » en référence au fait que cet acide est suffisamment fort pour protoner les hydrocarbures, ce qui a été spectaculairement illustré par J. Lukas, un chercheur postdoctoral allemand de l'équipe du chimiste américain George A. Olah (prix Nobel de chimie 1994), qui est parvenu à dissoudre une bougie dans ce mélange.
| Acide magique | |||
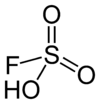  Composants de « l'acide magique ». |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | acide fluorosulfurique - pentafluoro-λ5-stibane (1:1) | ||
| No CAS | |||
| No ECHA | 100.041.727 | ||
| No CE | 245-915-8 | ||
| Propriétés chimiques | |||
| Formule | H[SbF5OSO2F] | ||
| Masse molaire[1] | 316,822 ± 0,007 g/mol H 0,32 %, F 35,98 %, O 15,15 %, S 10,12 %, Sb 38,43 %, |
||
| pKa | −20 | ||
| Précautions | |||
| SGH[2] | |||
   Danger |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Propriétés et réactions chimiques
Un mélange HSO3F - SbF5 1:1 conduit à l'espèce chimique HSO3F·SbF5, qui s'ionise presque totalement en H+ et [SbF5OSO2F]− :
- HSO3F·SbF5 → H+ + SbF6− + SO3
avec un pKa inférieur à -20[3] (par comparaison, celui de l'acide sulfurique à 100 % est de l'ordre de -3).
Au contact de l'eau, l'acide magique s'hydrolyse de façon explosive en acide sulfurique H2SO4 et acide fluoroantimonique HSbF6, ce dernier étant le plus fort des superacides connus :
Olah et al. ont publié en mai 1968 la conversion du méthane CH4 en carbocation tert-butyle C+(CH3)3 par l'acide magique à 140 °C[4]. La réaction commence par la protonation du méthane en méthanium CH5+, qui se dissocie immédiatement en hydrogène H2 et méthylium CH3+, ce dernier réagissant à son tour avec le méthane restant :
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) University of Memphis, Department of Chemistry – novembre 2010 « Section 8 Sykes CH5 electron deficient centers. » CHEM 43-6311, page 1.
-
(en) George A. Olah, Richard H. Schlosberg, « Chemistry in super acids. I. Hydrogen exchange and polycondensation of methane and alkanes in FSO3H-SbF5 ("magic acid") solution. Protonation of alkanes and the intermediacy of CH5+ and related hydrocarbon ions. The high chemical reactivity of "paraffins" in ionic solution reactions », Journal of the American Chemical Society, vol. 90, no 10, , p. 2726-2727 (lire en ligne)
DOI 10.1021/ja01012a066
Voir aussi
Articles connexes
Liens externes
- (en) University of Southern California – 8 décembre 1994 « My search for carbocations and their role in chemistry, » par George A. Olah à l'occasion de son prix Nobel.
- (en) George A. Olah, « Crossing Conventional Boundaries in Half a Century of Research », Journal of Organic Chemistry, vol. 70, no 7, , p. 2413-2429 (lire en ligne)
DOI 10.1021/jo040285o
