Acide tétrafluoroborique
L’acide tétrafluoroborique, ou plus simplement acide fluoroborique, est un composé chimique de formule HBF4. C'est un acide fort, de force du même ordre que l'acide nitrique. On le trouve dans le commerce sous forme de solution aqueuse ou dans d'autres solvants, tels que l'éther diéthylique.
| Acide tétrafluoroborique | |
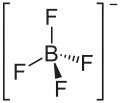 Structure de l'acide tétrafluoroborique |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.037.165 |
| No CE | 240-898-3 |
| No RTECS | ED2685000 |
| PubChem | 28118 |
| ChEBI | 38902 |
| InChI | |
| Propriétés chimiques | |
| Formule | HBF4 |
| Masse molaire[1] | 87,813 ± 0,007 g/mol H 1,15 %, B 12,31 %, F 86,54 %, |
| pKa | −4,9[2] |
| Propriétés physiques | |
| T° fusion | −78 °C[3] |
| T° ébullition | 130 °C (décomposition)[3] |
| Masse volumique | 1,38 g·cm-3 à 20 °C[3] |
| Précautions | |
| SGH[3] | |
 Danger |
|
| Transport[3] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Fabrication
On ne produit pas l'acide pur, mais on obtient des solutions aqueuses de HBF4 par solvatation à 20-25 °C de l'acide borique H3BO3 dans de l'acide fluorhydrique[4], qui est lui-même une solution aqueuse de fluorure d'hydrogène HF :
Utilisations
L'acide tétrafluoroborique est un catalyseur d'alkylation et de polymérisation.
En solution aqueuse, c'est un électrolyte utilisé dans certaines cellules électrochimiques de détection de l'oxygène, constituées d'une anode, d'une cathode et d'une membrane perméable à l'oxygène ; la solution aqueuse de HBF4 dissout l'oxyde de plomb(II) de l'anode sous forme de tétrafluoroborate de plomb en laissant le reste du système intact.
On réalise un étamage électrochimique à l'aide d'un mélange de trioxyde de chrome CrO3, d'acide tétrafluoroborique HBF4 et d'acides sulfoniques HSO3R avec traitement de la cathode. Les électrolytes utilisés dans ces traitements cathodiques sont des mélanges de fluoroborate d'étain(I) et d'acide tétrafluoroborique.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Fluoroboric Acid », sur PubChem.
- (en) D. T. Flood, « Fluorobenzene », Org. Synth., Vol. 2, p. 295.
