Béryllocène
Le béryllocène ou bis(η1,η5-cyclopentadiényl)béryllium(II), est un composé organométallique du béryllium de la famille des métallocènes. Dans les conditions normales, c'est un solide incolore mais à −60 °C dans l'éther de pétrole il se présente sous la forme d'aiguilles blanches. Il se décompose rapidement au contact du oxygène et de l'eau [1].
| Béryllocène | |
| |
| Identification | |
|---|---|
| Nom UICPA | béryllocène |
| Synonymes |
bis(cyclopentadiényl)béryllium(II) |
| No CAS | |
| SMILES | |
| InChI | |
| Apparence | cristal incolore[1] |
| Propriétés chimiques | |
| Formule | C10H10Be |
| Masse molaire[2] | 139,198 6 ± 0,008 7 g/mol C 86,28 %, H 7,24 %, Be 6,47 %, |
| Propriétés physiques | |
| T° fusion | 59 °C[1] |
| T° ébullition | 233 °C[1] |
| Solubilité | soluble dans le benzène, l'éther diéthylique et l'éther de pétrole[1] |
| Précautions | |
| SGH[3] | |
| H301, H315, H317, H319, H330, H335, H350i, H372 et H411 |
|
| Transport | |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés
Propriétés physiques
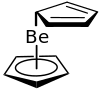
Par contraste avec les métallocènes de métaux de transition V, Cr, Fe, Co, Ni, Ru et Os, qui possèdent une structure symétrique et donc un moment dipolaire global nul, le béryllocène possède un fort moment dipolaire, de 2,46 D dans le benzène, ou de 2,24 D dans le cyclohexane, ce qui indique une asymétrie dans la molécule. Son spectre infrarouge comporte des bandes à 1524, 1610, 1669, 1715 et 1 733 cm−1, ce qui montre également que la structure de ce composé ne peut être similaire à celle du ferrocène[1]. La RMNH montre d'autre part à une température de −135 °C un seul signal, indiquant soit une structure symétrique, soit une fluctuation rapide des cycles[4].
En fonction de son état physique, le béryllocène montre des géométries moléculaires différentes. Une analyse par cristallographie aux rayons X à basse température montre une structure « sandwich-glissée », c'est-à-dire des cycles décalés, un cycle étant coordonné η5 avec une distance Be-Cp de 152 pm, le second ayant seulement une coordination η1 avec une distance Be-Cp de 181 pm[5] - [6] - [7]. La raison de cette structure η5,η1 est que les orbitales du béryllocène ne peuvent être occupées que par 8 électrons de valence. En phase gazeuse, les deux cycles apparaissent comme coordonnés η5, mais en fait un deux cycles est nettement plus loin de l'atome central que l'autre (distances de 190 et 147 pm) et cette coordination apparente η5 est due à une fluctuation rapide de la liaison[8]. Une étude par diffraction électronique en phase gazeuse à 120 °C de 1979 par Arne Haarland a montré que les cycles étaient décalés d'environ 80 ppm et n'ont pas une coordination η5,η1 mais plutôt η5,η3[4].
Ernesto Carmon et al. ont étudié par cristallographie aux rayons X la structure du béryllocène avec des ligands plus encombrés stériquement : Be(C5Me4H)2 et Be(C5Me5)2. Ils ont constaté qu'à l'état solide Be(C5Me4H)2 avait une structure sandwich glissé avec une coordination η5,η1, alors que Be(C5Me5)2 avait une coordination classique η5,η5. Dans le cristal, les liaisons Be-C n'ont pas toutes la même longueur mais varient entre 196,9(1) et 211,4(1) pm[9].
Propriétés chimiques
Dans le tétrahydrofurane (THF), le béryllocène se décompose assez rapidement pour donner un gel jaunâtre. Les cristaux de bélyllocène forment en contact avec l'oxygène de l'air une couche d'oxyde à leur surface, et ils réagissent violemment avec l'eau pour former l'hydroxyde de béryllium et le cyclopentadiène[1] :
- Be(C5H5)2 + 2 H2O → Be(OH)2 + 2 C5H6
Comme le magnésocène, le béryllocène réagit avec le chlorure de fer(II) pour former le ferrocène[1]. La force motrice de cette réaction est la formation du ferrocène qui est particulièrement stable.
- Be(C5H5)2 + FeCl2 → BeCl2 + Fe(C5H5)2
Synthèse
Le béryllocène fut synthétisé la première fois en 1959 par Ernst Otto Fischer et Hermann Pankraz Hofmann à partir de chlorure de béryllium et de cyclopentadiénure de sodium dans le benzène ou le diéthyléther[1] :
- 2 BeCl2 + 2 M(C5H5) → Be(C5H5)2 + 2 MCl (M=Na, K)
Sécurité
Comme tous les composés du béryllium, le béryllocène est hautement toxique et cancérigène.
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Beryllocen » (voir la liste des auteurs).
- (de) Ernst Otto Fischer, Hermann P. Hofmann, « Über Aromatenkomplexe von Metallen, XXV. Di-cyclopentadienyl-beryllium », Chem. Ber., vol. 92, no 2, , p. 482–486 (DOI 10.1002/cber.19590920233)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Arne Almenningen, Arne Haaland, Janusz Lusztyk, « The molecular structure of beryllocene (C5H5)2Be. A reinvestigation by gas phase electron diffraction », J. Organomet.Chem., vol. 170, no 3, , p. 271–284 (DOI 10.1016/S0022-328X(00)92065-5)
- (de) Christoph Elschenbroich, Organometallchemie, B. G. Teubner Verlag, , 764 p. (ISBN 978-3-8351-0167-8), p. 60
- C.-H. Wong, T.-Y. Lee, K.-J. Chao and S. Lee, « Crystal structure of bis(cyclopentadienyl)beryllium at −120 °C », Acta Cryst., vol. B28, , p. 1662–1665 (DOI 10.1107/S0567740872004820)
- J. Huheey, E. Keiter, R. Keiter, Anorganische Chemie, de Gruyter Verlag, (ISBN 3-11-017903-2), p. 799
- Erwin Riedel, Moderne Anorganische Chemie, de Gruyter, , 886 p. (ISBN 978-3-11-019060-1), p. 623
- María del Mar Conejo, Rafael Fernández, Enrique Gutiérrez-Puebla, Ángeles Monge, Caridad Ruiz, Ernesto Carmona, « Synthesis and X-ray Structures of [Be(C5Me4H)2] and [Be(C5Me5)2] », Angewandte Chemie, vol. 112, no 11, , p. 2025–2027 (DOI 10.1002/1521-3757(20000602)112:11<2025::AID-ANGE2025>3.0.CO;2-A)
