Acide syringique
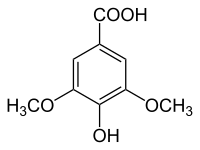
L'acide syringique ou acide 4-hydroxy-3,5-diméthoxybenzoïque est un composé aromatique naturel de la famille des acides hydroxybenzoïques, de formule C9H10O5. Il est constitué d'un cycle benzène substitué par un groupe carboxyle, un groupe hydroxyle en position para, et deux groupes méthoxyle occupant les positions méta. Il est ainsi l'éther diméthylique de l'acide gallique.
| Acide syringique | |
| |
| Identification | |
|---|---|
| DCI | acide syringique |
| Nom systématique | acide 4-hydroxy-3,5-diméthoxybenzoïque |
| Synonymes |
3,5-diméthyléther de l'acide gallique |
| No CAS | |
| No ECHA | 100.007.716 |
| PubChem | 10742 |
| SMILES | |
| InChI | |
| Apparence | poudre blanc cassé[1] ou biege, inodore[2] |
| Propriétés chimiques | |
| Formule | C9H10O5 [Isomères] |
| Masse molaire[3] | 198,172 7 ± 0,009 4 g/mol C 54,55 %, H 5,09 %, O 40,37 %, |
| Propriétés physiques | |
| T° fusion | 206 à 209 °C[1] |
| Solubilité | 5,8 g·L-1 (eau, 25 °C)[2] |
| Précautions | |
| SGH[2] | |
 |
|
| Écotoxicologie | |
| LogP | 1,04[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
Il se présente sous la forme d'une poudre blanc cassé ou beige inodore. C'est un métabolite courant dans le monde végétal.
Son nom, comme pour ses analogues – syringol, syringalcool, syringaldéhyde ou acétosyringone –, vient de Syringa, le nom latin du lilas, car il dérive de la syringine, un glucoside qui a été découvert en premier dans l'écorce du lilas.
Occurrence naturelle
On trouve l'acide syringique dans de nombreuses plantes, notamment Ardisia elliptica et Schumannianthus dichotomus[4].
Présence dans la nourriture
L'acide syringique est présent dans de nombreux fruits, et entre autres les olives, les dattes, les citrouilles, le palmier acai[5], le miel et certaintes épices[6]. On le trouve à de plus fortes concentrations dans les baies bleues comme les myrtilles ou les raisins rouges[7], et donc dans le vin rouge. Il est notamment formé par décomposition de l'œnine, un anthocyane, et son aglycone la malvidine, des colorants responsables de la couleur du raisin et du vin rouge. Sa présence dans le shedeh, une boisson de l'Égypte antique pourrait permettre de confirmer qu'il était fait à partir de raisin. Il est présent également dans le vinaigre[8].
Synthèse
L'acide syringique peut être synthétisé en hydrolysant (déméthylation) sélectivement l'acide eudesmique avec 20% d'acide sulfurique[9].
Utilisation
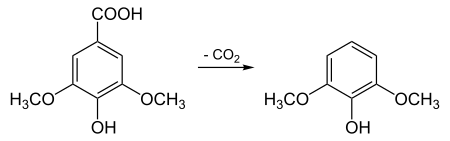
Il est possible de synthétiser le syringol par décarboxylation de l'acide syringique.
Du fait qu'il dérive de l'œnine, un colorant naturel qui participe à la couleur du vin rouge, il sert en archéologie à déterminer si des amphores ayant contenu du vin ont contenu du vin rouge ou blanc.
Diverses études ont montré que l'acide syringique présente des propriétés pharmaceutiques utiles telles qu'antioxydant, antimicrobien, anti-inflammatoire, anticancéreux et antidiabétique[6].
L'acide syringique peut être polymérisé par voie enzymatique. La laccase et la peroxydase induisent la polymérisation de l'acide syringique pour donner le poly(oxyde de phénylène) portant un groupe carboxyle a une extrémité et un groupe phénolique à l'autre[10].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Syringic acid » (voir la liste des auteurs).
- Fiche Sigma-Aldrich du composé Syringic acid analytical standard, consultée le 13 septembre 2020..
- Fiche Carl Roth (de) de « Syringasäure », consultée le 13 septembre 2020
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Md. Mahfuzur Rob, Kawsar Hossen, Arihiro Iwasaki, Kiyotake Suenaga et Hisashi Kato-Noguchi, « Phytotoxic Activity and Identification of Phytotoxic Substances from Schumannianthus dichotomus », Plants, vol. 9, no 1, , p. 102 (ISSN 2223-7747, PMID 31947649, PMCID 7020185, DOI 10.3390/plants9010102)
- Pacheco-Palencia LA, Mertens-Talcott S, Talcott ST, « Chemical composition, antioxidant properties, and thermal stability of a phytochemical enriched oil from Acai (Euterpe oleracea Mart.) », J Agric Food Chem, vol. 56, no 12, , p. 4631–4636 (PMID 18522407, DOI 10.1021/jf800161u)
- Cheemanapalli Srinivasulu, Mopuri Ramgopal, Golla Ramanjaneyulu, C.M. Anuradha et Chitta Suresh Kumar, « Syringic acid (SA) ‒ A Review of Its Occurrence, Biosynthesis, Pharmacological and Industrial Importance », Biomedicine & Pharmacotherapy, vol. 108, , p. 547–557 (ISSN 0753-3322, PMID 30243088, DOI 10.1016/j.biopha.2018.09.069)
- John M. Pezzuto, « Grapes and Human Health: A Perspective », Journal of Agricultural and Food Chemistry, vol. 56, no 16, , p. 6777–6784 (ISSN 0021-8561, PMID 18662007, DOI 10.1021/jf800898p)
- Analysis of polyphenolic compounds of different vinegar samples. Miguel Carrero Gálvez, Carmelo García Barroso and Juan Antonio Pérez-Bustamante, Zeitschrift für Lebensmitteluntersuhung und -Forschung A, Volume 199, Number 1, pages 29–31, DOI 10.1007/BF01192948
- Marston Bogert et Ehrlich, Jacob, « The synthesis of certain pyrogallol ethers, including a new acetophenetide derived from the ethyl ether of syringic acid », Journal of the American Chemical Society, vol. 41, no 5, , p. 798–810 (DOI 10.1021/ja02226a013, lire en ligne, consulté le )
- Hiroshi Uyama, Ryohei Ikeda, Shigeru Yaguchi et Shiro Kobayashi, Polymers from Renewable Resources, vol. 764, coll. « ACS Symposium Series », , 113 p. (ISBN 0-8412-3646-1, DOI 10.1021/bk-2000-0764.ch009), « Enzymatic Polymerization of Natural Phenol Derivatives and Enzymatic Synthesis of Polyesters from Vinyl Esters »