Malvidine
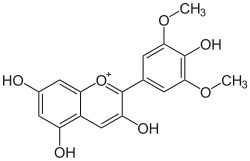
La malvidine (ou malvidol) est un composé organique de la famille des anthocyanidols O-méthylés, un sous-groupe de flavonoïdes. Sous forme hétéroside, c'est un pigment végétal abondant dans la nature. Il colore les fleurs de géraniums bleus et joue un rôle dans la couleur des vins rouges jeunes. Comme les autres anthocyanidols, il possède une activité anti-oxydante.
| Malvidine | |
| |
| Malvidine | |
| Identification | |
|---|---|
| Nom UICPA | 3,5,7-trihydroxy-2-(4-hydroxy- 3,5-dimethoxyphenyl)chromenium |
| No CAS | (chlorure) |
| PubChem | 159287 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C17H15O7 |
| Masse molaire[1] | 331,296 8 ± 0,016 8 g/mol C 61,63 %, H 4,56 %, O 33,81 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés
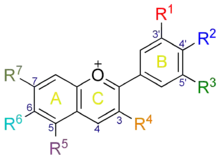
La malvidine fait partie des six anthocyanidols principaux rencontrés chez les plantes (avec la cyanidine, la delphinidine, la pélargonidine, la péonidine et la pétunidine). Dans ce groupe, elle se caractérise par la présence d'un groupement hydroxyle -OH en position 4' et encadré de deux groupements méthoxyles -CH3 en position 3' et 5' sur le cycle aromatique B (voir la numérotation dans la table 1).
En raison de son noyau flavylium possédant une forte réactivité avec les nucléophiles, la malvidine est une molécule relativement instable et donc peu présente sous forme libre dans les tissus végétaux[2]. L'addition d'un sucre en position C-3 (par O-glycosylation) lui confère une meilleure stabilité et solubilité. D'une manière générale, les hétérosides formés par condensation de la malvidine et d'un ou plusieurs oses (éventuellement acylés) forment des anthocyanosides (ou anthocyanes) beaucoup plus stables.
En laboratoire, elle se présente sous forme d'une poudre rouge brune à noire
Hétérosides de malvidine dans l'alimentation
Sur les 539 anthocyanosides recensés par Andersen et Jordheim[3] en 2006, on en trouve 39 basés sur la malvidine.
La base PHENOL-EXPLORER[4] indique 7 glycosides de malvidine importants trouvés dans l'alimentation européenne. Le vin rouge et le raisin noir sont riches en dérivés de malvidine mais moins que les airelles nord américaines Vaccinium angustifolium et Vaccinium corymbosum.
| Table 1. Fruits et légumes riches en hétérosides de malvidine, d'après Phe[4] | |
 | |
| Malvidine-3-O-glucoside | Vin rouge (9,97 mg/100g), frambroise rouge (0,62 mg/100g), Vaccinium angustifolium (26,06 g/100g), Vaccinium corymbosum (11,18 mg/100g), raisin noir (Vitis vinifera) (39,23 mg/100g) |
| Malvidine-3-O-galactoside | Vaccinium angustifolium (21,43 g/100g), Vaccinium corymbosum (17,23 mg/100g) |
| Malvidine-3-O-arabinoside | Vaccinium angustifolium (7,89 g/100g), Vaccinium corymbosum (13,42 mg/100g) |
| Malvidine-3,5-O-diglucoside | Nectarine |
| Malvidine-3-O-(6"-acetyl-galactoside) | Vaccinium angustifolium (5,79 g/100g), Vaccinium corymbosum (2,64 mg/100g) |
| Malvidine-3-O-(6"-acetyl-glucoside) | Vin rouge (3,52 mg/100g), Vaccinium angustifolium (14,74 g/100g), Vaccinium corymbosum (3,29 mg/100g), raisin noir (9,66 mg/100g) |
| Malvidine-3-O-(6"-caffeoyl-glucoside) | Vin rouge |
| Malvidine-3-O-(6"-p-coumaroyl-glucoside) | Vin rouge, raisin noir |
Pigment coloré des végétaux
Les dérivés de la malvidine constituent des pigments qui colorent les fleurs, fruits ou feuilles de certaines plantes en teintes allant du rouge au bleu.
- Les Géraniums bleus
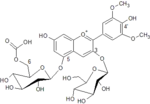
L'étude des pigments des fleurs de trois géraniums bleu pourpre permet de comprendre comment on peut passer du bleu plus ou moins teinté de pourpre du Geranium 'Johnson's Blue', au bleu pourpré (devenant pourpre bleuté en fanant) du Geranium pratense jusqu'au magenta du Geranium sanguineum, sachant que tous les trois sont dotés du même pigment anthocyanosidique. On observe en effet dans leurs pétales une forte prédominance de glycosides de malvidine avec de petites quantités de glycosides des autres anthocyanidols. Le pigment largement dominant est une malvidine[5] avec deux glucoses positionnés en 3 et 5 (ce dernier acylé), soit précisément la Malvidin-3-O-glucoside-5-O-(6-acetylglucoside) (1). La teinte bleuté de ces fleurs ne s'explique pas par la chélation d'ions métalliques mais par la différence de pH des tissus et des variations concentrations en copigments.
 |
 |
 | |
| Geranium 'Johnson's Blue | G. pratense | G. sanguineum | |
|---|---|---|---|
| pH (jus) | 5,40 | 5,43 | 4,63 |
| Flav/Anth | 2:1 | 4:1 | 1:5 |
| 1 : Mv3G5AcG (% des Anth.) | 90 | 74,6 | 92,2 |
| Mv3-5diG (%) | 5,2 | 14.9 | 4,7 |
Comme tous les anthocyanosides, le pigment 1 est sensible au changement de pH, en passant du rouge en milieu acide (pH faible) au bleu en pH intermédiaire (voir influence du pH). En milieu aqueux, on observe qu'un équilibre s'établit entre plusieurs formes : le cation flavylium AH+ rouge et les bases quinoniques A bleu-mauve. La mesure du pH du jus exprimé des pétales[N 1] indique un pH plus acide pour le G. sanguineum (pH=4,6) que pour les deux autres géraniums (pH=5,4), expliquant ainsi ses teintes magenta.
Le pigment de malvidine est accompagné de copigments flavoniques : des 3-O-glucoside et 3-O-sophorosides de kaempférol et de myricétol pour 'Johnson's Blue' et G. pratense mais avec un faible taux de flavonols pour le géranium sanguin. Les copigments en proportions différentes par rapport aux anthocyanosides contribuent à déplacer plus ou moins la couleur les bleus et à stabiliser les pigments. Ils agissent en combinaison avec une auto-association des bases quinoniques du pigment de malvidine[6] capables de s'empiler verticalement les uns sur les autres. Les anthocyanosides acylées montrent une plus grande stabilité due au phénomène de copigmentation intramoléculaire alors que pour ceux qui ne sont pas acylés c'est la copigmentation intermoléculaire qui joue un rôle clé dans la stabilité de la couleur.
- Les pétunias bleu pourpre

Les glycosides de malvidine sont présents majoritairement dans les pétunias bleu pourpre. Une analyse en composantes principales du contenu en anthocyanidols des fleurs de 195 cultivars a donné trois classes[7] : la première qui accumule principalement la cyanidine est formée de 69 cultivars de couleurs rouges ou saumon, la seconde accumulant principalement la malvidine comporte 67 cultivars dans les bleus à pourpres et la dernière qui accumule la péonidine comprend 59 cultivars roses.
- La couleur du vin
Tout comme le milieu des cellules vivantes en perpétuelle évolution, le vin est un produit qui évolue constamment en vieillissant. Au cours de la première année de vieillissement, le vin change de couleur sous l'effet de la diminution de ses pigments et de leurs copigments associés puis de la formation de polymères et de nouveaux pigments dérivés des anthocyanosides.
Les anthocyanosides du vin rouge sont principalement des 3-O-monoglucosides (et leurs formes 3-O-acylées) de malvidine, delphinidine, pétunidine, cyanidine et péonidine, dans l'ordre décroissant de leur quantité. Les concentrations varient énormément suivant les années, les cépages, les techniques de vinification. À cela s'ajoute une variation dans le temps puisque dès la fermentation alcoolique terminée, les concentrations commencent à diminuer rapidement et régulièrement. Après 9 mois, seuls demeurent 40 % des anthocyanosides monomères pour la syrah et 32 % pour le cabernet sauvignon[8] (table 2). Au bout de quelques années, il n'y en pratiquement plus, bien que le vin soit encore rouge mais avec des teintes tuilées. Le malvidine 3-O-glucoside est le plus abondant des anthocyanosides du vin[N 2], c'est aussi celui (avec ses formes acylées) qui est le plus rouge[9]. En raison de sa diminution rapide, il ne peut contribuer à la couleur rouge du vin que lorsqu'il est jeune.
| Table 2. Composition du vin cabernet sauvignon à la fin de la fermentation alcoolique (FFA) et 9 mois plus tard, d'après Gutiérez et als[8] (2005) | |||||
 | |||||
| Anthocyanosides du vin cabernet sauvignon en mg/l | |||||
| Malv-3G | Malv-3G-Ac | Del-3G | Pet-3G | ||
| FFA | 316 | 159 | 35,3 | 34,6 | |
| 9 mois | 122 | 49,9 | 11,9 | 10,9 | |
| Flavonols en mg/l | |||||
| Quer-3G | Quer-3Glucu | Myr-3G | Kaemp-3G-ara | ||
| FFA | 25,6 | 25,6 | 19,8 | 8,5 | |
| 9 mois | 4,1 | 5,1 | 5,6 | 1,4 | |
| Contribution à la couleur | |||||
| %Copig | %Polym | L* | C* | ||
| FFA en % | 42,6 | 20,3 | 48,00 | 53,28 | |
| 9 mois en % | nd | 44,4 | 55,72 | 38,15 | |
La disparition des anthocyanosides s'explique par leur instabilité. Une petite partie disparaît par oxydation, précipitation et formation de composés incolores comme les castavinols. La plus grande partie se combine ou se condense avec d'autres composés phénoliques. Dans les années 2000, de nombreuses études ont essayé d'évaluer le rôle de la copigmentation dans la couleur des vins rouges[10]. Les copigments les plus efficaces sont les flavonols, comme les 3-glucosides de quercétine (Quer-3G), de myricétine (Myr-3G), le quercétine-3-glucuronide (Quer-3Glucu) et le kaempférol-3-glucosylarabinoside. Le pourcentage de copigmentation (%Copig) mesure l'apport de la copigmentation à la couleur du vin. Pour le cabernet sauvignon et la syrah, la fraction de la couleur rouge due aux anthocyanosides copigmentés est d'environ 43 % à la fin de la fermentation alcoolique. Puis on observe une diminution rapide et une quasi-disparition de l'effet au bout de 9 mois.
Par contre, le degré de polymérisation (%Polym) des anthocyanosides augmente de manière conséquente durant la même période. Cet accroissement est à mettre en relation avec la diminution des anthocyanosides monomères. Ceux-ci forment de nouveaux pigments rouges polymériques par condensation avec des flavan-3-ols et des pyranoanthocyanosides. Les mesures de couleurs faites dans le système CIELAB ont indiqué que le vieillissement s'accompagnait d'un éclaircissement (augmentation de L*) et des teintes moins pures (diminution de C*).
Notes
- le pH des vacuoles des cellules épidermiques serait de 1 à 1,4 unité supérieure à celle du jus exprimé par pression
- environ 50 % des anthocyanosides la première année
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- P. Sarni-Manchado, V. Cheynier, Les polyphénols en agroalimentaire, Lavoisier, Editions Tec & Doc, , 398 p. (ISBN 2-7430-0805-9)
- Oyvind Anderson et Monica Jordheim, « The Anthocyanins », FLAVONOIDS Chemistry, Biochemistry and Applications, M. Andersen, K.R. Markham et CRC Press,
- PHENOL-EX
- Kenneth R. Markham, « Malvidin-3-O-glucoside-5-O-(6-acetylglucoside) and its colour manifestation in ‘Johnson's Blue’ and other ‘Blue’ geraniums », Phytochemistry, vol. 45, no 2, , p. 417-423 (ISSN 0031-9422, DOI 10.1016/S0031-9422(96)00831-X, lire en ligne)
- Tsutomu Hoshino, « An approximate estimate of self-association constants and the self-stacking conformation of Malvin quinonoidal bases studied by 1H NMR », Phytochemistry, vol. 30, no 6, , p. 2049-2055 (ISSN 0031-9422, DOI 10.1016/0031-9422(91)85065-8, lire en ligne, consulté le )
- Toshio Ando, « Delphinidin accumulation is associated with abnormal flower development in petunias », Phytochemistry, vol. 65, no 15, , p. 2219-2227 (ISSN 0031-9422, DOI 10.1016/j.phytochem.2004.06.028, lire en ligne, consulté le )
- Isidro Hermosı́n Gutiérrez, « Phenolic composition and magnitude of copigmentation in young and shortly aged red wines made from the cultivars, Cabernet Sauvignon, Cencibel, and Syrah », Food Chemistry, vol. 92, no 2, , p. 269-283 (ISSN 0308-8146, DOI 10.1016/j.foodchem.2004.07.023, lire en ligne, consulté le )
- Fei He, « Anthocyanins and Their Variation in Red Wines I. Monomeric Anthocyanins and Their Color Expression », Molecules, vol. 17, no 2, , p. 1571-1601 (ISSN 1420-3049, DOI 10.3390/molecules17021571, lire en ligne)
- Roger Boulton, « The Copigmentation of Anthocyanins and Its Role in the Color of Red Wine: A Critical Review », American Journal of Enology and Viticulture, vol. 52, no 2, , p. 67-87 (ISSN 0002-9254, lire en ligne)