Péonidine
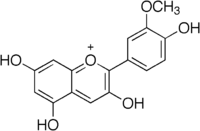
La péonidine (ou péonidol) est un composé organique de la famille des anthocyanidols O-méthylés, un sous-groupe de flavonoïdes. C'est un pigment végétal important qui, associé aux flavones et flavonols, donne par exemple la couleur rose à certains cultivars de pivoine de Chine (Paeonia lactiflora) dont elle tient son nom. Elle est aussi présente dans certaines fleurs bleues, comme certaines Ipomoea.
| Péonidine | |
| |
| Identification | |
|---|---|
| Nom UICPA | 2-(4-hydroxy-3-méthoxyphenyl)chroménylium-3,5,7-triol |
| No CAS | (chlorure) |
| No CE | 205-125-6 |
| PubChem | 441773 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C16H13O6 [Isomères] |
| Masse molaire[1] | 301,270 8 ± 0,015 5 g/mol C 63,79 %, H 4,35 %, O 31,86 %, |
| Unités du SI et CNTP, sauf indication contraire. | |

Propriétés
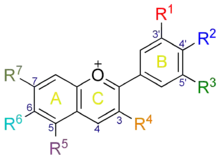
La péonidine fait partie des six anthocyanidols principaux rencontrés chez les plantes (avec la cyanidine, la delphinidine, la pélargonidine, la malvidine et la pétunidine). Dans ce groupe, elle se caractérise par la présence d'un groupement hydroxyle (-OH) en position 4' et d'un groupement méthoxyle -CH3 en position 3' sur le cycle aromatique B (voir la numérotation dans la table 1).
En raison de son noyau flavylium possédant une forte réactivité avec les nucléophiles, la péonidine est une molécule relativement instable à pH faible et donc peu présente sous forme libre dans les tissus végétaux[2]. L'addition d'un sucre en position C-3 (par O-glycosylation) lui confère une meilleure stabilité et solubilité. D'une manière générale, les hétérosides formés par condensation de la péonidine et d'un ou plusieurs oses (éventuellement acylés) qui font partie de la famille des anthocyanosides ou anthocyanes, sont plus stables.
A l'état pur, en laboratoire, elle se présente sous forme d'un solide de couleur beige à rouge-brun, soluble dans l'éthanol et l'eau. Elle doit être stockée à l’abri de la lumière.
Péonidine et ses hétérosides dans l'alimentation
Sur les 539 anthocyanosides recensés par Andersen et Jordheim[3] en 2006, on trouve 39 hétérosides de péonidine.
La base PHENOL-EXPLORER[4] indique sept 3-O-glycosides de péonidine importants trouvés dans l'alimentation européenne :
| Table 1. Fruits et légumes riches en péonidine et en ses 3-O-glycosides | |
 | |
| Péonidine | Haricot (noir) (1,36 mg/100g) |
| Peonidin 3-O-(6"-acetyl-galactoside) | Vaccinium augustifolium Ait. (1,76 mg/100g) |
| Peonidin 3-O-(6"-acetyl-glucoside) | Vaccinium corymbosum, Vaccinium augustifolium, vin rouge (0,47 mg/100g) |
| Peonidin 3-O-(6"-p-coumaroyl-glucoside) | Raisin noir (0,34 mg/100g), vin rouge (0,52 mg/100g) |
| Peonidin 3-O-arabinoside | Canneberge d'Amérique (Vaccinium macrocarpon Ait.) (9,61 mg/100g), Vaccinium corymbosum |
| Peonidin 3-O-galactoside | Canneberge d'Amérique (Vaccinium macrocarpon Ait.) (22,02 mg/100g), Vaccinium corymbosum, Vaccinium augustifolium |
| Peonidin 3-O-glucoside | Raisin noir (5,80 mg/100g), Vaccinium augustifolium (5,53 mg/100g), Canneberge d'Amérique (Vaccinium macrocarpon Ait.) (4,16 mg/100g); vin rouge (0,82 mg/100g) |
| Peonidin 3-O-rutinoside | Cerise douce (Prunus avium L. ) (7,42 mg/100g), cerise acide (Prunus cerasus L.), prune fraîche (P. domestica) (4,85 mg/100g), cassis (Ribes nigrum) (1,27 mg/100g) |
De loin, la plus grande source alimentaire en hétérosides de péonidine est les canneberges d'Amérique (ou cranberries), qui en contiennent 42 mg pour 100 g de fruit[5]. Les myrtilles, les prunes, le raisin et les cerises contiennent également des quantités significatives, allant de 5 à 12 mg/100 g. Seuls les fruits frais présentent des quantités significatives de péonidine; les myrtilles congelées par exemple n'en contiennent quasiment plus. La péonidine a aussi été isolée dans le riz complet, les bananes noires et les patates douces[6].
Pigment coloré des végétaux
Comme la plupart des anthocyanidols, la péonidine est sensible au pH et change du rouge au bleu quand celui-ci croit. In vitro, on observe qu'à pH 2, la péonidine est rouge cerise, à 3, elle passe à un rose-jaunâtre soutenu, à 5 elle est rouge-violacé comme du raisin, et à 8 elle prend un teinte bleu profond. Contrairement à de nombreux anthocyanidols, elle est stable à pH élevé, et a été isolée comme pigment bleu dans l'Ipomoea tricolor.
De par son inhabituelle stabilité en termes de couleurs, une formule caféyl-acylée tamponnée a été brevetée pour un usage de colorant alimentaire. Son code est E163e.
On trouve la péonidine, souvent associée avec des co-pigments flavoniques, dans des fleurs roses comme certains cultivars de pétunia ou de pivoine.
Une équipe de chercheurs japonais, animée par T. Ando[7] a classé 195 cultivars de pétunias du commerce en fonction de leur contenu en anthocyanidols de leurs pétales.
.jpg.webp) |
 |
| Petunia x atkinsiana, hybride |
| R3 | R5 | Anthocyanidol | R | Résidu | |
|---|---|---|---|---|---|
| OCH3 | H | Péonidine | H | p-coumaryl | |
| OCH3 | OCH3 | Malvidine | OH | caféyl | |
| Pétunia rose : peonidin 3-caffeoylrutinoside-5-glucoside, peonidin 3-p-coumaroylrutinoside-5-glucoside | |||||
| Pétunia bleu pourpre : malvidin 3-caffeoylrutinoside-5-glucoside, malvidin 3-p-coumaroylrutinoside-5-glucoside | |||||
L'analyse en composantes principales du contenu relatif en anthocyanidols a donné trois classes accumulant principalement soit la cyanidine, soit la péonidine soit la malvidine. La pélargonidine n'a pas été détectée et la delphinidine est un constituant minoritaire. La première classe est formée de 69 cultivars qui accumulent la cyanidine, la deuxième est formée de 59 cultivars accumulant la péonidine et la troisième de 67 cultivars pour la malvidine et accessoirement une sous-classe de 7 cultivars accumulant la pétunidine. Les fleurs du groupe contenant principalement de la péonidine sont formées exclusivement de pétunias roses. Les fleurs accumulant principalement de la cyanidine sont rouges à saumon et celles accumulant la malvidine sont bleues ou pourpres.
Les glycosides de péonidine sont acylés par l'acide p-coumarique et l'acide caféique. Ainsi, on trouve dans les cultivars aux fleurs roses, 'Pink Magic' et 'Pink Grandball', le peonidin 3-caffeoylrutinoside-5-glucoside et le peonidin 3-p-coumaroylrutinoside-5-glucoside[8] et la forme non acylée (peonidin 3-rutinoside-5-glucoside). Récemment deux autres glycosides acylés de péonidine ont été détectés[N 1] - [9].
- Pivoine de Chine (Paeonia lactiflora)
Une équipe de chercheurs chinois (Ni Jia et als[10], 2008) a analysé la corrélation entre la couleur des pétales de 41 cultivars de Paeonia lactiflora et leur composition en anthocyanosides.
 |
 |
| Paeonia lactiflora | Peonidin 3,5-diglucoside |
La mesure des paramètres de la couleur par spectrophotomètre, une fois reportée dans le système de représentation CIE Lab, permet de distinguer quatre groupes : les fleurs pourpres (20 cultivars), les fleurs roses (16 cultivars), les fleurs blanches (4 cultivars) et un cultivar de fleur jaune. Le chromatogramme typique HPLC des anthocyanosides montre 5 pics correspondant aux : peonidin-3,5-diglucoside (Pn3G5G), peonidin-3-O-glucoside (Pn3G), cyanidin-3,5-diglucoside (Cy3G5G), cyanidin-3-O-glucoside (Cy3G), pelargonidin-3,5-diglucoside (Pg3G5G). Les diglucosides (3G5G) sont très dominants par rapport aux monoglucosides (3G), présents dans très peu de cultivars et en très petites quantités.
Aucun anthocyanoside n'a été détecté dans deux cultivars (un blanc pur et un jaune). Le peonidin-3,5-diglucoside Pn3G5G est très dominant dans tous les autres cultivars. Il représente plus de 80 % des anthocyanosides pour la plupart d'entre eux. Une analyse par régression linéaire multiple permet de voir que le Pn3G5G, le Cy3G5G et le Pg3G5G sont les facteurs principaux influençant les paramètres de couleur. Tous ont des effets positifs sur la valeurs de a*[N 2](et tirent vers le rouge) et Pn3G5G, Pg3G5G ont des effets négatifs sur les valeurs de b* (donc tirent vers le bleu). La totalité des anthocyanosides TA fait décroître la valeur de la clarté L*, ce qui veut dire que plus les pétales sont sombres plus la concentration TA en anthocyanosides est élevée.
Il existe un groupe de six cultivars ne contenant que le Pn3G5G. Il est formé de trois cultivars rose pâle et trois cultivars blancs. Tous possèdent en outre des flavones et flavonols. Les fleurs roses possèdent un taux TA plus élevé que les blanches et proportionnellement moins de flavones et flavonols.
Un autre groupe de 11 cultivars est formé de fleurs roses composées de Pn3G5G et Cy3G5G. Le dernier groupe qui contient toutes les fleurs pourpres a pour pigments trois anthocyanosides : Pn3G5G, Cy3G5G et Pg3G5G. C'est donc le 3,5-diglucoside de pélargonidine (Pg3G5G) qui est le composant discriminant permettant de distinguer les fleurs roses des fleurs pourpres.
- Ipomoea tricolor cv. 'Heavenly Blue'

La corolle bleue de l'Ipomée tricolore ne contient qu'un seul pigment anthocyanosidique mais c'était le plus complexe connu en 1987 (Kondo et als[11], 1987). Sa structure consiste en une molécule de péonidine, de 6 molécules de glucose et de 3 molécules d'acide caféique[N 3]. Le bouton floral est rouge pourpre puis la corolle passe au bleu azur clair lorsqu'elle s'épanouit. Or, la composition en anthocyanosides ne change pas au cours du processus. Et le chromophore étant la péonidine, il n'y a pas de complexation avec un métal pour expliquer la couleur bleue. Ce changement de couleur est un rare cas où le changement de pH est le facteur décisif[N 4]. La mesure du pH dans les vacuoles des cellules de surface a montré que le pH des cellules rouges était de 6,6 et que celui des cellules bleu azur était de 7,7. C'est un système actif de transport d'ions Na+ ou K+ du cytosol dans les vacuoles qui fait passer le pH vacuolaire de 6,6 à 7,7 durant l'ouverture de la fleur. Le milieu faiblement alcalin produit le bleu azuré des pétales[12].
Effets thérapeutiques
La péonidine, comme de nombreux anthocyanidols, a montré de puissants effets inhibiteurs et apoptotiques sur les cellules cancéreuses in vitro, notamment sur les cellules humaines de cancer du sein métastatiques[13]. Cependant, une question demeure à propos de la pénétration et la rétention des anthocyanidines dans les cellules humaines in vivo, puisqu'elles seraient rapidement éliminées par le corps humain.
Notes
- peonidin 3-O-[6-O-(4-O-(4-O-(6-O-(trans-caffeoyl)-β-D-glucopyranosyl)-trans-p-coumaroyl)-α-L-rhamnopyranosyl)-β-D-glucopyranoside]-5-O-[β-D-glucopyranoside], peonidin 3-O-[6-O-(4-O-(4-O-(β-D-glucopyranosyl)-trans-p-coumaroyl)-α-L-rhamnopyranosyl)-β-D-glucopyranoside]-5-O-[β-D-glucopyranoside]
- a* est un axe allant du vert au rouge pour a* croissant, donc les diglucosides tirent vers le rouge
- 3-0-(2-0- (6-O-(trans-3-O-(b-D-glucopyranosyl)caffeyl)-b-D-glucopyranosyl)-6-O-(trans-4-O- (6-0-(trans-3-0-(b-D-glucopyranosyl)caffeyl)-b-D-gluco-pyranosyl)caffeyl)-b-Dglucopyranosyl)- 5-O-(H-D-glucopyranosyl)peonidin
- pour quelques explications, voir anthocyane#Facteurs influençant la couleur
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- P. Sarni-Manchado, V. Cheynier, Les polyphénols en agroalimentaire, Lavoisier, Editions Tec & Doc, , 398 p. (ISBN 2-7430-0805-9)
- Oyvind Anderson, Monica Jordheim, « The Anthocyanins », in "FLAVONOIDS Chemistry, Biochemistry and Applications" Ed. Andersen, K. Markham, CRC,
- PHENOL-EX
- Peonidin Explained - Which foods contain peonidin?
- Kinnosuke Odake, « Chemical structures of two anthocyanins from purple sweet potato, Ipomoea batatas », Phytochemistry, vol. 31, no 6, , p. 2127-2130 (ISSN 0031-9422, DOI 10.1016/0031-9422(92)80378-R, lire en ligne, consulté le )
- Toshio Ando, « Delphinidin accumulation is associated with abnormal flower development in petunias », Phytochemistry, vol. 65, no 15, , p. 2219-2227 (ISSN 0031-9422, DOI 10.1016/j.phytochem.2004.06.028, lire en ligne, consulté le )
- R.J. Griesbach, « Petunia hybrida anthocyanins acylated with caffeic acid », Phytochemistry, vol. 30, no 5, , p. 1729-1731 (ISSN 0031-9422, DOI 10.1016/0031-9422(91)84250-V, lire en ligne, consulté le )
- Fumi Tatsuzawa, « Acylated peonidin 3-rutinoside-5-glucosides from commercial petunia cultivars with pink flowers », Heterocycles, vol. 63, no 3, , p. 509-517 (ISSN 0385-5414, lire en ligne, consulté le )
- Ni Jia, « Analysis of petal anthocyanins to investigate coloration mechanism in herbaceous peony cultivars », Scientia Horticulturae, vol. 117, no 2, , p. 167-173 (ISSN 0304-4238, DOI 10.1016/j.scienta.2008.03.016, lire en ligne, consulté le )
- Tadao Kondo, « Structure determination of heavenly blue anthocyanin, a complex monomeric anthocyanin from the morning glory ipomea tricolor, by means of the negative NOE method », Tetrahedron Letters, vol. 28, no 20, , p. 2273-2276 (ISSN 0040-4039, DOI 10.1016/S0040-4039(00)96099-4, lire en ligne, consulté le )
- Kumi Yoshida, « The involvement of tonoplast proton pumps and Na+(K+)/H+ exchangers in the change of petal color during flower opening of Morning Glory, Ipomoea tricolor cv. Heavenly Blue », Plant & Cell Physiology, vol. 46, no 3, , p. 407-415 (ISSN 0032-0781, DOI 10.1093/pcp/pci057, lire en ligne, consulté le )
- JUNG YEON KWON, KI WON LEE, HAENG JEON HUR, HYONG JOO LEE (2007) Peonidin Inhibits Phorbol-Ester-Induced COX-2 Expression and Transformation in JB6 P+ Cells by Blocking Phosphorylation of ERK-1 and -2,Annals of the New York Academy of Sciences 1095 (1), 513–520 (January, 2007).