Acide hydroxylamine-O-sulfonique
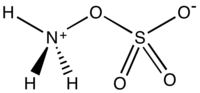
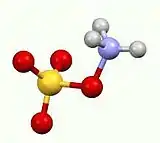
L'acide hydroxylamine-O-sulfonique est un composé inorganique de formule brute H3NO4S, formé par la sulfonation de l'hydroxylamine avec de l'oléum[2]. C'est un solide blanc, hydrosoluble et hygroscopique, généralement représenté par la formule développée condensée H2NOSO3H, bien qu'il existe en fait sous la forme d'un zwitterion[3] et qu'il est donc plus précisément représenté par +H3NOSO3−. Il est utilisé comme réactif pour l'introduction de groupes amines ( –NH2), pour la conversion d'aldéhydes en nitriles et de cétones alicycliques en lactames (amides cycliques) et pour la synthèse de divers hétérocycles contenant de l'azote[3] - [4] - [5].
| Acide hydroxylamine-O-sulfonique | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | Acide hydroxylamine-O-sulfonique | |
| No CAS | ||
| No ECHA | 100.019.065 | |
| SMILES | ||
| InChI | ||
| Apparence | solide blanc | |
| Propriétés chimiques | ||
| Formule | H3NO4S [Isomères] |
|
| Masse molaire[1] | 113,093 ± 0,007 g/mol H 2,67 %, N 12,39 %, O 56,59 %, S 28,35 %, |
|
| Propriétés physiques | ||
| T° fusion | 210 °C | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Préparation
Selon le procédé de laboratoire[2], l'acide hydroxylamine-O-sulfonique peut être préparé en traitant du sulfate d'hydroxylamine avec de l'acide sulfurique fumant (oléum). Le processus industriel est similaire[6].
- (NH3OH)2SO4 + 2SO3 → 2H2NOSO3H + H2SO4
La sulfonation de l'hydroxylamine peut également être effectuée avec de l'acide chlorosulfurique[3] selon une méthode publiée pour la première fois en 1925[7] et améliorée dans Organic Syntheses[8].
Structure
De manière analogue à l'acide sulfamique (H3N+ SO3− ) et à la majorité des acides aminés, l'acide hydroxylamine-O-sulfonique existe à l'état solide sous la forme d'un zwitterion : H3N+OSO3−. Il ressemble à une molécule d'ammoniac liée de manière covalente à un groupe sulfate[9].
Réactions
L'acide hydroxylamine-O-sulfonique réagit dans des conditions basiques en tant que nucléophile et dans des conditions neutres et acides en tant qu'électrophile[4].
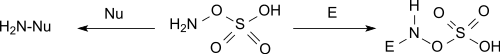
Aminations
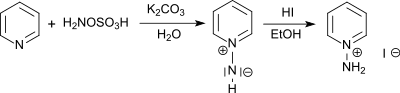
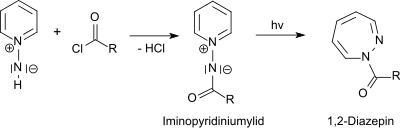
Il réagit avec les amines tertiaires pour former des sels d'hydrazinium trisubstitués et avec la pyridine pour former un sel de 1-aminopyridinium[10].
À partir des sels de 1-aminopyridinium, les ylures de 1-N-iminopyridinium photochimiquement actifs sont accessibles par acylation[11]. Le réarrangement photochimique des ylures de 1-N-iminopyridinium obtenus conduit, avec des rendements élevés, à des 1H -1,2-diazépines[12].
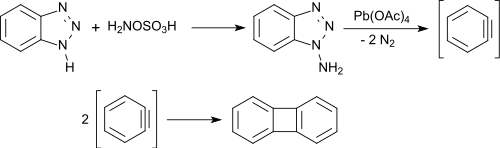
La N-amination de la 1H-benzotriazole avec de l'acide hydroxylamine-O-sulfonique donne un mélange de 1-aminobenzotriazole (produit majoritaire) et de 2-aminobenzotriazole (produit minoritaire). À partir de la 1-aminotriazole, le benzyne est formé avec un rendement presque quantitatif par oxydation avec de l’acétate de plomb(IV). Le benzyne se dimérise rapidement en biphénylène avec un bon rendement[13].
Les hétérocycles électrophiles, tels que le tétrazole, peuvent être N-aminés grâce à l'acide hydroxylamine-O-sulfonique, tandis que des composés encore plus électrophiles, tels que le 5-nitrotétrazole, ne réagissent qu'avec des agents d'amination plus puissants tels que l’O-tolylhydroxylamine ou l’O-mésitylène sulfonylhydroxylamine en composés amino, qui ont été étudiés comme explosifs[14].
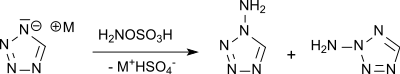
Dans la N-amination du tétrazole non substitué, un mélange de 1-amino et de 2-aminotétrazole est obtenu.
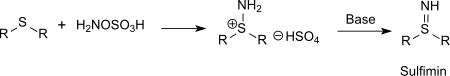
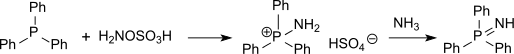
Des composés soufrés (tels que les thioéthers ) peuvent également être aminés avec de l'acide hydroxylamine-O-sulfonique en sulfinimines (isostériques avec des sulfoxydes mais beaucoup plus instables) ou des composés du phosphore (tels que la triphénylphosphine) peuvent être aminés en phosphine-imides via l'hydrogénosulfate d'aminotriphénylphosphonium[15].
La réaction de l'acide hydroxylamine-O-sulfonique avec des sels métalliques d'acide sulfinique dans une solution d'acétate de sodium génère des sulfamides primaires avec de très bons rendements[16].
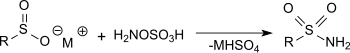
La diimine peut se former in situ à partir de l'acide hydroxylamine-O-sulfonique ou de mélange d'acide hydroxylamine-O-sulfonique et de sulfate d'hydroxylamine, qui hydrogènent sélectivement les liaisons multiples conjuguées.
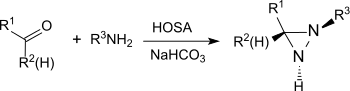
Réactions avec des composés carbonylés
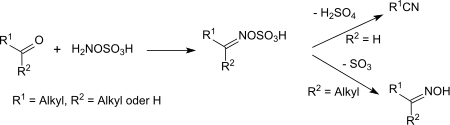
À température ambiante et au-dessous, l'acide hydroxylamine-O-sulfonique réagit avec les cétones et les aldéhydes en tant que nucléophile pour produire les acides oxime-O-sulfoniques correspondants ou leurs sels[17]. Les acides oxime-O-sulfoniques d'aldéhydes réagissent au-dessus de la température ambiante pour former, par l'élimination d'acide sulfurique, des nitriles, avec des rendements élevés[18].
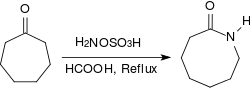
Les cétones aliphatiques fournissent dans des conditions similaires des oximes avec des rendements très élevés, les arylalkyl cétones réagissent dans un réarrangement de Beckmann en amides[19]. Lorsqu'elles sont chauffées à reflux pendant plusieurs heures dans des conditions acides (par exemple en présence d'acide méthanoïque concentré), les cétones alicycliques réagissent pour donner des lactames avec des rendements élevés[20].
Dans des conditions basiques en présence d'amines primaires, l'acide hydroxylamine-O-sulfonique forme des aldéhydes et des cétones (par exemple, la cyclohexanone[21]), des diaziridines, qui peuvent facilement être oxydées en diazirines plus stables.
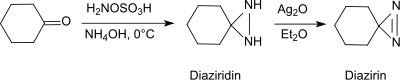
La réaction fournit également des aziridines substituées à partir d'aldéhydes et de cétones simples avec un rendement élevé et une diastéréosélectivité[22].
La 1,2-benzisoxazole est efficacement produite par l'attaque nucléophile de l'acide hydroxylamine-O-sulfonique sur le groupe carbonyle du 2-hydroxybenzaldéhyde, suivie d'une cyclisation[23].
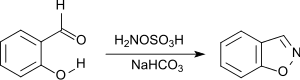
Le 1,2-benzisoxazole est un élément structural de la rispéridone et de la palipéridone (antipsychotiques), ainsi que du zonisamide (antiépileptique.
Dans une synthèse monotope, les N-aryl[3,4-d]pyrazolopyrimidines sont obtenues avec de bons rendements à partir du 4,6-dichloropyrimidine-5-carboxaldéhyde[24].
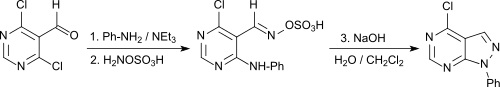
Ces molécules peuvent être utilisées comme analogues de la purine pour une large gamme d'applications diagnostiques et thérapeutiques[25].
Autres réactions
L'ajout d'acide hydroxylamine-O-sulfonique augmente considérablement la chimiluminescence du système luminol/chlorure de cobalt(II)[26].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Hydroxylamine-O-sulfonic acid » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Harold J. Matsuguma, Ludwig F. Audrieth et Herbert L. Wehrmeister, Hydroxylamine-O-Sulfonic Acid, vol. 5, coll. « Inorganic Syntheses », , 122–125 p. (ISBN 9780470132364, DOI 10.1002/9780470132364.ch32)
- (en) Egon Wiberg et Nils Wiberg, Inorganic Chemistry, Academic Press, , 675–677 p. (ISBN 978-0-12-352651-9), « Sulfur Compounds of Nitrogen »
- (en) Wallace, « Hydroxylamine-O-sulfonic acid – a versatile synthetic reagent », Aldrichimica Acta, vol. 13, no 1, , p. 3–11 (lire en ligne)
- (en) P. Rademacher, Compounds with One Saturated Carbon–Heteroatom Bond: Amine N-Oxides, Haloamines, Hydroxylamines and Sulfur Analogues, and Hydrazines, vol. 40b, Georg Thieme Verlag, coll. « Science of Synthesis: Houben-Weyl Methods of Molecular Transformations », (ISBN 978-3-13-172181-5), « Product Class 7: Hydrazines and Hydrazinium Salts (40.7.1.1.9.2 – Using Hydroxylamine-O-sulfonic Acids », p. 1171
- (en) Herbert L. Wehrmeister et Harold I. Yalowitz, « US patent 3281209 : Process for the preparation of hydroxylamine-O-sulfonic acid », sur Google Patents,
- (de) Sommer, Schulz et Nassau, « Über die Sulfoperamidsäure », Z. Anorg. Allg. Chem., vol. 147, no 1, , p. 142–155 (DOI 10.1002/zaac.19251470115)
- Boranes in functionalization of olefins to amines: 3-Pinanamine (Bicyclo[3.1.1heptan-3-amine, 2,6,6-trimethyl-)], Org. Synth. 58, coll. « vol. 6 », , 32 p., p. 943
- (en) Baenziger, Belt et Goebel, « Crystal structure of hydroxylamine-O-sulfonic acid », Inorg. Chem., vol. 6, no 3, , p. 511–514 (DOI 10.1021/ic50049a017)
- (en) R. Gösl et A. Meuwsen, « 1-Aminopyridinium iodide », Organic Syntheses, vol. 43, , p. 1 (ISSN 0078-6209, DOI 10.15227/orgsyn.043.0001)
- (en) Jacques Streith, « The Photochemistry of N-Iminopyridinium Ylides in Retrospect. From a Simple Concept to Some Applications », CHIMIA International Journal for Chemistry, vol. 45, no 3, , p. 65–76
- (en) Jacques Streith, « The photochemistry of aromatic-N-ylides. Rearrangement and fragmentation patterns », Pure and Applied Chemistry, vol. 49, no 3, , p. 305–315 (ISSN 0033-4545, DOI 10.1351/pac197749030305)
- (en) Campbell et Rees, « Reactive intermediates. Part I. Synthesis and oxidation of 1- and 2-aminobenzotriazole », Journal of the Chemical Society, vol. 1969, no 5, , p. 742–747 (DOI 10.1039/J39690000742)
- (en) Thomas M. Klapötke, Davin G. Pierceya et Jörg Stierstorfera, « Amination of energetic anions: high-performing energetic materials », Dalton Transactions, vol. 41, no 31, , p. 9451–9459 (ISSN 1477-9226, PMID 22751656, DOI 10.1039/C2DT30684K)
- (de) Rolf Appel et Werner Büchner, « Zur Kenntnis des Imins, I. Über Phosphinimine und Sulfinimine », European Journal of Organic Chemistry, vol. 618, no 1, , p. 53–58 (DOI 10.1002/jlac.19586180107)
- (en) « The reaction of sulfinic acid salts with hydroxylamine-O-sulfonic acid. A useful synthesis of primary sulfonamides », Synthesis, Thieme, vol. 1986, no 2, , p. 1031–1032 (DOI 10.1055/s-1986-31862)
- (en) Jacques Streith et Christian Fizet, « Nucleophilic versus electrophilic properties of the nitrogen atom in O-sulfonyl-hydroxylamine derivatives », Tetrahedron Letters, vol. 18, no 37, , p. 3297–3300 (DOI 10.1016/S0040-4039(01)83223-8)
- (en) Jacques Streith et Christian Fizet, « Hydroxylamine-O-sulfonic acid: A convenient reagent for the oxidative conversion of aldehydes into nitriles », Tetrahedron Letters, vol. 15, no 36, , p. 3187–3188 (DOI 10.1016/S0040-4039(01)91857-X)
- Célina Reverdy, « Synthèse d'hétérocycles polysubstitués antaonistes des récepteurs dopaminergiques D3>D2 et sérotoninergique 5-HT6 à visée antipsychotique », Université de Nantes (Thèse), (lire en ligne)
- (en) George A. Olah et Alexander P. Fung, « Hexahydro-2-(1H)-azocinone », Organic Syntheses, vol. 63, , p. 188 (DOI 10.15227/orgsyn.063.0188)
- (en) Ernst Schmitz et Roland Ohme, « 3,3-Pentamethylenediaziridine », Organic Syntheses, vol. 45, , p. 83 (DOI 10.15227/orgsyn.045.0083)
- (en) A.W. Beebe, E.F. Dohmeier et G. Moura-Letts, « Diastereoselective synthesis of substituted diaziridines from simple ketones and aldehydes », Chemical Communications, vol. 51, no 70, , p. 13511–13514 (PMID 26216745, DOI 10.1039/C5CC04813C)
- (en) D.S. Kemp et R.B. Woodward, « The N-ethylbenzisoxazolium cation—I : Preparation and reactions with nucleophilic species », Tetrahedron, vol. 21, no 11, , p. 3019–3035 (DOI 10.1016/S0040-4020(01)96921-2)
- (en) Lindsay E. Evans, Matthew D. Cheeseman et Keith Jones, « N–N Bond-Forming Cyclization for the One-Pot Synthesis of N-Aryl[3,4-d]pyrazolopyrimidines », Organic Letters, vol. 14, no 13, , p. 3546–3549 (DOI 10.1021/ol301561a)
- (en) Christie Morrill, Suresh Babu, Neil G. Almstead et Young-Choon Moon, « Synthesis of 1,4-disubstituted pyrazolo[3,4-d]pyrimidines from 4,6-dichloropyrimidine-5-carboxaldehyde: insights into selectivity and reactivity », Synthesis, vol. 45, no 13, , p. 1791–1806 (DOI 10.1055/s-0033-1338862)
- (en) Muhammad Saqib, Wenyue Gao, Jianping Lai, Liming Qi, Saadat Majeed, Muhammad Rehan, Hasan Shah Gilaniab et Guobao Xu, « Hydroxylamine-O-sulfonic acid as an efficient coreactant for luminol chemiluminescence for selective and sensitive detection », Chemical Communications, vol. 51, no 30, , p. 6536–6539 (PMID 25766485, DOI 10.1039/C5CC01090J)