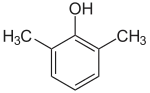
2,6-Xylénol
Le 2,6-xylénol, ou 2,6-diméthylphénol, est un composé chimique de formule HOC6H3(CH3)2. Cet isomère du xylénol est un monomère du poly(oxyde de p-phénylène) (PPO).
| 2,6-Xylénol | |
| |
| Structure du 2,6-xylénol | |
| Identification | |
|---|---|
| Nom UICPA | 2,6-diméthylphénol |
| No CAS | |
| No ECHA | 100.008.547 |
| No CE | 209-400-1 |
| No RTECS | ZE6125000 |
| PubChem | 11335 |
| ChEBI | 180557 |
| SMILES | |
| InChI | |
| Apparence | solide cristallisé incolore à jaunâtre s'assombrissant à la lumière ou après exposition à l'air, et à l'odeur âcre[1] |
| Propriétés chimiques | |
| Formule | C8H10O [Isomères] |
| Masse molaire[2] | 122,164 4 ± 0,007 4 g/mol C 78,65 %, H 8,25 %, O 13,1 %, |
| Propriétés physiques | |
| T° fusion | 46 à 48 °C[1] |
| T° ébullition | 203 °C[1] |
| Solubilité | 6,1 g/L[1] à 25 °C |
| Masse volumique | 1,13 g/cm3[1] à 25 °C 0,89 g/cm3[1] à 48 °C |
| T° d'auto-inflammation | > 500 °C[1] |
| Point d’éclair | 85 °C[1] |
| Précautions | |
| SGH[1] | |
   Danger |
|
| NFPA 704[3] | |
| Transport[1] | |
| Écotoxicologie | |
| DL50 | 296 mg/kg[1] (souris, oral) |
| LogP | 2,36[1] (octanol/eau) |
| Unités du SI et CNTP, sauf indication contraire. | |
Le 2,6-xylénol peut être obtenu par méthylation du phénol C6H5OH à travers une réaction exothermique, par exemple à l'aide d'un catalyseur fer-chrome sur lit fluidisé[4].
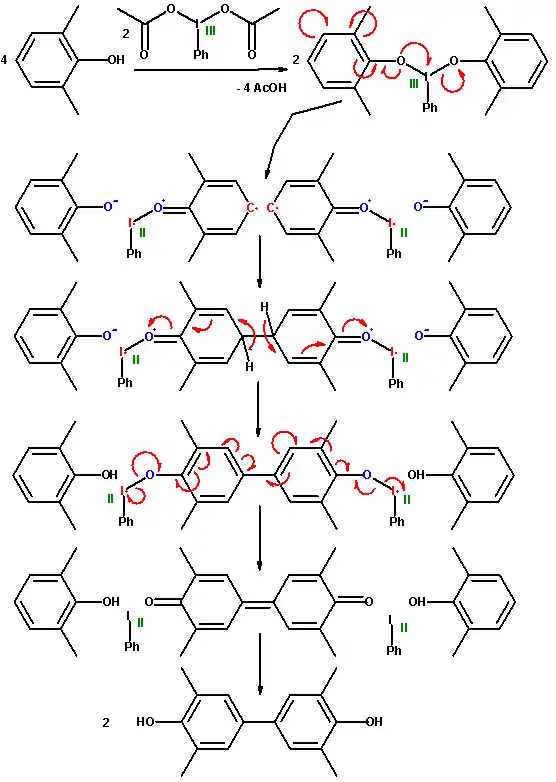
Le PPO peut être obtenu à partir de 2,6-xylénol par couplage oxydant carbone–oxygène. La dimérisation carbone–carbone est également possible ; une étude documente ainsi l'oxydation par le diacétate d'iodobenzène C6H5I(OCOCH3)2[5].
La première étape du mécanisme réactionnel proposé voit la substitution des groupes acétyle liés à l'iode par des groupes phénol. Ce complexe se dissocie en un radical anionique aryle et un groupe phénoxy. Les deux radicaux aryle forment une liaison covalente carbone–carbone avant d'éliminer deux protons, conduisant à une aromatisation. Cela donne une diphénoquinone, à la suite d'une oxydation à quatre électrons. Le biphénol peut être obtenu par médiamutation de la quinone avec le xylénol déjà présent. À l'issue de la séquence de réactions, le diacétate d'iodobenzène est réduit en iodobenzène C6H5I.
Notes et références
- Entrée « 2,6-Dimethylphenol » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 4 octobre 2022 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé 2,6-Dimethylphenol, 99% », sur Alfa Aesar (consulté le ).
-
(en) Witold Żukowski, Gabriela Berkowicz, Jerzy Baron, Stanisław Kandefer, Dariusz Jamanek, Stefan Szarlik, Zbigniew Wielgosz et Maria Zielecka, « Selective phenol methylation to 2,6-dimethylphenol in a fluidized bed of iron-chromium mixed oxide catalyst with o-cresol circulation », BMC Chemistry, vol. 8, no 1, , article no 51 (PMID 25342964, PMCID 4172955, DOI 10.1186/s13065-014-0051-6, lire en ligne
 ).
). - (en) Christophe Boldron, Guillem Aromí, Ger Challa, Patrick Gamez et Jan Reedijk, « Selective oxidative para C–C dimerization of 2,6-dimethylphenol », Chemical Communications, no 46, , p. 5808-5810 (PMID 16307153, DOI 10.1039/b510378a, lire en ligne).