Couplage oxydant
En chimie, le couplage oxydant est une réaction de couplage entre deux espèces organiques par un processus oxydant, généralement catalysé par un métal de transition[1], comme dans les réactions de couplage croisé, avec cependant un mécanisme réactionnel différent en raison de l'implication d'un oxydant[2] - [3]. Ces couplages font souvent intervenir l'oxygène comme oxydant stœchiométrique mais procèdent par transfert d'électron (en).
Couplages carbone–carbone
De nombreuses réactions de couplage oxydant créent des liaisons carbone–carbone. Les premiers exemples font intervenir des alcynes terminaux[4] :
Les réactions de couplage oxydant du méthane (en) sont étudiées afin de relier la chimie des composés en C1 à celle des composés en C2, à valeur industrielle sensiblement supérieure. Le couplage oxydant du méthane donne ainsi de l'éthylène C2H4[5] - [6] :
Dans le couplage oxydant aromatique, les réactifs sont des composés aromatiques riches en électrons. Les substrats typiques sont les phénols et les catalyseurs typiques sont des composés de cuivre et de fer ainsi que certaines enzymes[7]. La première application synthétique rapportée remonte à 1868 avec Julius Löwe et la synthèse de l'acide ellagique en chauffant l'acide gallique avec de l'acide arsénique H3AsO4 ou de l'oxyde d'argent(I) Ag2O[8]. Une autre réaction est la synthèse du 1,1'-bi-2-naphtol, ou (S)-BINOL, à partir du β-naphtol par le chlorure de fer(III) FeCl3, découverte en 1873 par le chimiste russe Alexandre Dianine[9]. Ce composé peut être produit à partir de β-naphtol par couplage oxydant asymétrique à l'aide de chlorure de cuivre(II) CuCl2[10].
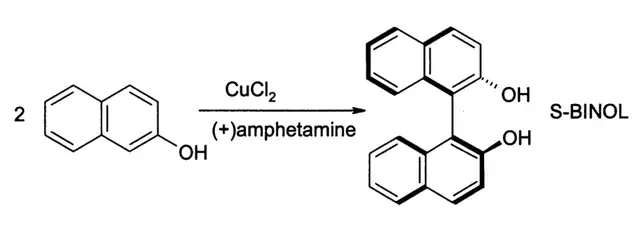 Couplage oxydant asymétrique de β-naphtol produisant du 1,1'-bi-2-naphtol.
Couplage oxydant asymétrique de β-naphtol produisant du 1,1'-bi-2-naphtol.
Notes et références
- (en) « oxidative coupling », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8)
- (en) Aiwen Lei, Wei Shi, Chao Liu, Wei Liu, Hua Zhang et Chuan He, Oxidative Cross-Coupling Reactions, Wiley, 26 August 2016, DOI 10.1002/9783527680986 (ISBN 978-3527680986).
- (en) Ignacio Funes-Ardoiz et Feliu Maseras, « Oxidative Coupling Mechanisms: Current State of Understanding », ACS Catalysis, vol. 8, no 2, , p. 1161-1172 (DOI 10.1021/acscatal.7b02974, lire en ligne).
- (en) Alison E. Wendlandt, Alison M. Suess et Shannon S. Stahl, « Copper-Catalyzed Aerobic Oxidative C–H Functionalizations: Trends and Mechanistic Insights », Angewandte Chemie International Edition, vol. 50, no 47, , p. 11062-11087 (PMID 22034061, DOI 10.1002/anie.201103945, lire en ligne).
- (en) Qijian Zhang, Dehua He et Qiming Zhu, « Recent Progress in Direct Partial Oxidation of Methane to Methanol », Journal of Natural Gas Chemistry, vol. 12, no 2, , p. 81-89 (lire en ligne).
- (en) G. Olah et A. Molnar, Hydrocarbon Chemistry, John Wiley & Sons, New York, 2003. (ISBN 978-0-471-41782-8)
- (en) Marek Grzybowski, Kamil Skonieczny, Holger Butenschön et Daniel T. Gryko, « Comparison of Oxidative Aromatic Coupling and the Scholl Reaction », Angewandte Chemie International Edition, vol. 52, no 38, , p. 9900-9930 (PMID 23852649, DOI 10.1002/anie.201210238, lire en ligne).
- (de) Löwe, Zeitschrift für Chemie, 1868, no 4, p. 603.
- (ru) A. P. Dianin, « O-va. », Zhurnal Fizicheskoi Khimii, 1874, p. 183.
- (en) J. Brussee et A. C. A. Jansen, « A highly stereoselective synthesis of s(-)-[1,1′-binaphthalene]-2,2′-diol », Tetrahedron Letters, vol. 24, no 31, , p. 3261-3262 (DOI 10.1016/S0040-4039(00)88151-4, lire en ligne).
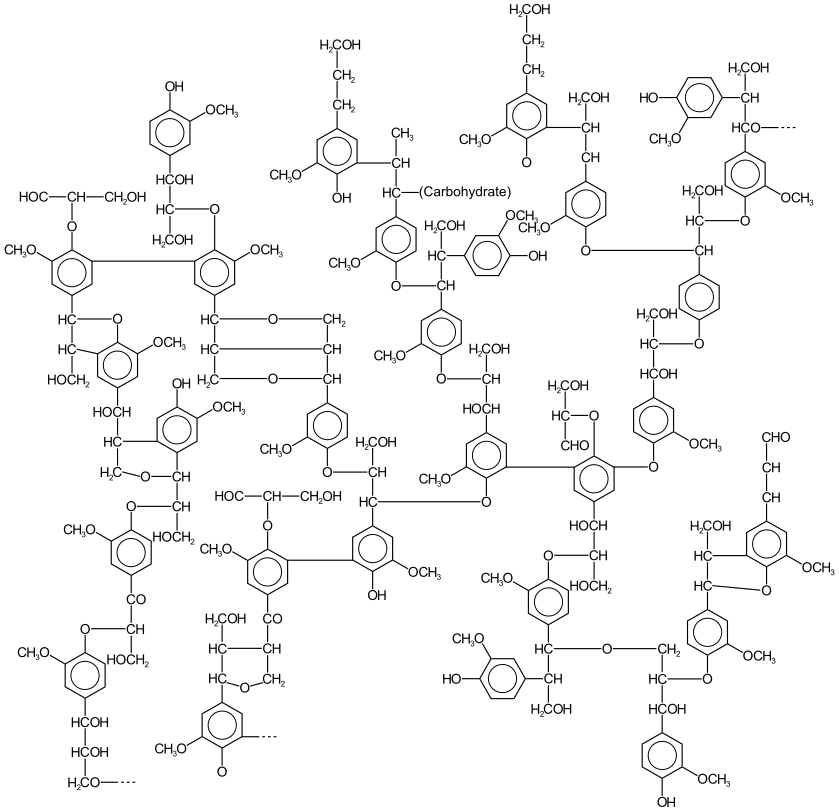
- (en) Jerry D. Gargulak, Stuart E. Lebo et Timothy J. McNally, « Lignin », Kirk-Othmer Encyclopedia of Chemical Technology, (DOI 10.1002/0471238961.12090714120914.a01.pub3, lire en ligne).