Unionidae
Les Unionidae sont une famille de mollusques bivalves d'eau douce appartenant à l'ordre monophylétique des Unionoida[1] - [2] - [3].
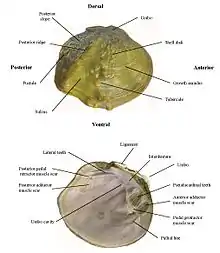









Les espèces de cette famille sont appelées communément moules de rivière ou moules d'eau douce ou mulettes. Certaines espèces peuvent atteindre une grande taille (jusqu'à 20 cm) et un grand âge (plus d'un siècle) avec localement (ou autrefois) des populations très denses,
Morphologie
Les coquilles sont plus ou moins solides ou épaisses selon l'âge et l'espèce, souvent avec deux valves d'apparence assez similaire, élongées, nacrées et présentant une sculpture radiale externes (marques de croissance)[3].
Écologie, traits de vie
Ces animaux « filtreurs » ne sont pas fixés mais vivent plus ou moins enfoncés dans le substrat au fond de l'eau, leur partie « postérieure » plus large hors du lit et le reste du corps enfoui (verticalement ou non) dans le limon, le gravier ou le sable.
Leur siphon court ne leur permet pas de se nourrir en étant enfoncé dans le sédiment (sauf pour le juvéniles dans un sédiment très macroporeux où l'eau circule bien). Leur coquille, qui contient des composés minéraux biosynthétisés, mais aussi une quantité significative de composés organiques est plus fragile que celles de bivalves marins de taille équivalente. Hermétiquement fermée, elle permet à l'animal de survivre un certain temps à l’exondation.
Ces moules sont habituellement mâle ou femelle, mais en cas de faible densité de population, au moins chez certaines espèces la femelle peut devenir hermaphrodite et s'autoféconder. C'est le cas par exemple pour Elliptio complanata ou Margaritifera margaritifera.
Le cycle de reproduction comprend une larve dite « glochidium » qui parasite certaines espèces de poissons. Les œufs, minuscules, sont produits en quantités énormes (jusqu'à deux millions chez les anodontes, environ deux cent mille chez les unios[7]). Après fécondation, ils s'accumulent dans le feuillet branchial externe de l'adulte. Au début du printemps, l'embryon sous la forme d'une larve glochidium est expulsé et mène une vie pélagique avant de se fixer sur les branchies (ou entre deux écailles d'un poisson). Le glochidium mesure alors quelques dixièmes de millimètres, il possède sa petite coquille à deux valves munies chacune d'un crochet qui permet la fixation. Il possède aussi un long filament correspondant au byssus qui permet le déplacement. La larve (glochidium) s'enkyste dans les tissus branchiaux de l'hôte aux dépens duquel elle se nourrit. Au bout de quelques semaines à quelques mois le kyste libère un jeune mollusque d'environ 10 millimètres qui tombe au fond et met environ trois ans à atteindre son complet développement.
Les grandes moules d’eau douce, quand elles sont abondantes et présentes à toutes les classes d'âge, sont généralement considérées comme de bon indicateur d’intégrité écologique, pour leur vulnérabilité à la dégradation des habitats aquatiques, ainsi qu'en raison de leur faible taux de recrutement impliquant des communautés minimales de poissons et la présence de leurs espèces hôtes.
État des populations, pressions, menaces
L'état des populations est très mal connu pour une grande partie de l'aire de répartition des espèces.
On découvre encore de nouvelles populations (par exemple en 2005 en Tunisie[8]).
Les populations de nombreuses espèces d'unionidae ont souvent localement disparu ou se sont drastiquement réduites depuis le début du XXe siècle[9], probablement à cause des impacts d'activités telles que la canalisation des cours d'eau, l'agriculture intensive (engrais, pesticides, érosion entrainant une augmentation anormale de la turbidité des rivières), déforestation, sylviculture intensive, exploitation forestière et flottage du bois, pollution des rivières par l'urbanisation, la périurbanisation et l'industrie, construction de grands barrages, le faucardage[10] et l'exploitation de gravières dans les fleuves[10], etc. Les perturbateurs endocriniens pourraient aussi éventuellement être en cause (chez la moule, comme chez l'embryon ou la larve). Ils ont un rôle délétère ou reprotoxique qui a été démontré chez d'autres espèces, mais ne semblent pas avoir été étudiés chez les unionidae).
Les larves sont très sensibles à certains métaux lourds (plomb, mercure, cadmium, mais aussi cuivre[11] fréquemment utilisé comme pesticide sous forme de sulfate de cuivre (bouillie bordelaise), ou relargué dans l'eau par des tuyauteries. Selon une étude nord américaine[12], certaines molécules présentes dans les eaux usées en sortie stations d'épuration affectent aussi les larves, en particulier les dérivés de l'ammoniac, et les chloramines (monochloramines surtout) alors que les systèmes de fosses septiques ne montrent pas d'impact significatifs. Les œufs pourraient être sensibles aux faibles quantités de pesticides de plus en plus souvent trouvées dans les eaux superficielles depuis les années 1960.
Conservation, statut des espèces et surexploitation centenaire de certaines espèces
Certaines espèces ont été consommées par l'Homme préhistorique ou plus récemment dans certaines parties du monde.
Alors qu'on ne connaissait pas encore l'écologie particulière de ces espèces, les moules d'eau douce ont été surexploitées dans une grande partie de l'Amérique du Nord, essentiellement à partir du milieu du XIXe siècle, pour :
- les perles d'eau douce,
- la fabrication de boutons de nacre
- la production de perles cultivées.
Partout et au même rythme, les rendements annuels de moules d'eau douce ont décru en Amérique du Nord, surtout aux États-Unis, avant que les captures par unité d'effort (CPUE) s'effondrent dans quelques-uns des plus importants sites américains de récolte de moules[13].
Environ 70 % des espèces d'unionidés nord-américains sont soit déjà éteintes (21 espèces), en voie de disparition (77 espèces), menacés (43 espèces) ou inscrites sur les listes d'espèces dont l'état est jugé préoccupant (72 espèces)[14] - [15] - [16].
Des projets de gestion durable des ressources aquatiques peuvent inclure des plans de restaurations et des réintroductions, mais la moule dépend aussi d'un habitat restauré (qu'elle contribue à restaurer par ses capacités de filtration) et de la présence de ses poissons-hôtes. Dans certains sites, le recrutement de jeunes générations est tombé à zéro, alors que des adultes sont encore relativement présents.
Taxonomie
Selon World Register of Marine Species (16 octobre 2019)[17], il y a 6 sous-familles, dont une douteuse, et trois genres non attribués:
- Ambleminae Rafinesque, 1820
- Gonideinae Ortmann, 1916
- Modellnaiinae Brandt, 1954
- Parreysiinae Henderson, 1935
- Unioninae Rafinesque, 1820
- Psilunioninae Starobogatov, 1970 (taxon inquirendum)
- Unionidae incertae sedis
- Germainaia Graf & Cummings, 2009
- Haasodonta McMichael, 1956
- Mujanaia Delvene, Munt, Piñuela & García-Ramos, 2016 †
Liste des genres
Selon ITIS :
- genre Actinonaias Crosse et P. Fischer, 1893
- genre Alasmidonta Say, 1818
- genre Amblema Rafinesque, 1820
- genre Anodonta Lamarck, 1799
- genre Anodontoides Baker, 1898
- genre Arcidens Simpson, 1900
- genre Arkansia Ortmann et Walker, 1912
- genre Canthyria Swainson, 1840
- genre Cyclonaias Pilsbry, 1922
- genre Cyprogenia Agassiz, 1852
- genre Cyrtonaias Crosse et P. Fischer, 1894
- genre Disconaias P. Fischer et Crosse, 1894
- genre Dromus Simpson, 1900
- genre Dysnomia L. Agassiz, 1852
- genre Ellipsaria Rafinesque, 1820
- genre Elliptio Rafinesque, 1819
- genre Elliptoideus Frierson, 1927
- genre Epioblasma Rafinesque, 1831
- genre Fusconaia Simpson, 1900
- genre Glebula Conrad, 1853
- genre Gonidea Conrad, 1857
- genre Hemistena Rafinesque, 1820
- genre Lampsilis Rafinesque, 1820
- genre Lasmigona Rafinesque, 1831
- genre Lemiox Rafinesque, 1831
- genre Leptodea Rafinesque, 1820
- genre Lexingtonia Ortmann, 1914
- genre Ligumia Swainson, 1840
- genre Medionidus Simpson, 1900
- genre Megalonaias Utterback, 1915
- genre Obliquaria Rafinesque, 1820
- genre Obovaria Rafinesque, 1819
- genre Pegias Simpson, 1900
- genre Plectomerus Conrad, 1853
- genre Plethobasus Simpson, 1900
- genre Pleurobema Rafinesque, 1819
- genre Popenaias Frierson, 1927
- genre Popenais Frierson, 1927
- genre Potamilus Rafinesque, 1818
- genre Proptera Rafinesque, 1819
- genre Ptychobranchus Simpson, 1900
- genre Pyganodon Crosse et P. Fischer, 1894
- genre Quadrula Rafinesque, 1820
- genre Quincuncina Ortmann, 1922
- genre Simpsonaias Frierson, 1914
- genre Strophitus Rafinesque, 1820
- genre Toxolasma Rafinesque, 1831
- genre Tritogonia Agassiz, 1852
- genre Truncilla Rafinesque, 1819
- genre Uniomerus Conrad, 1853
- genre Utterbackia Frierson, 1927
- genre Venustaconcha Thiele, 1934
- genre Villosa Frierson, 1927
Sous-familles, genres et espèces en France
Au moins six espèces sont autochtones sont connues en France, réparties en 3 sous-familles et 4 genres[18] :
- Sous-famille des Ambleminae :
- genre Potomida Swainson, 1840
- Potomida littoralis (Cuvier, 1798) - Mulette des rivières
2. Sous-famille des Unioninae
- genre Unio Retzius, 1788
- Unio mancus (Lamarck, 1819)
- Unio pictorum (Linnaeus, 1758)
3. Sous-famille des Anodontinae
- genre Anodonta Lamark, 1799
- Anodonta cygnea (Linnaeus, 1758)
- Anodonta anatina (Linnaeus, 1758)
- genre Pseudanodonta Bourguignat, 1876
- Pseudanodonta complanata (Rossmässler, 1835) - Anodonte comprimée ou Moule d'étang aplatie
A ces genres et espèces autochtones, s'ajoute, au sein de la sous-famille des Anodontinae, une espèce originaire d'Asie, Sinanodonta woodiana, introduite en France au milieu des années 1980[18].
Illustration de la variété des formes et couleurs d'Unionidae

 Quadrula cylindrica strigillata
Quadrula cylindrica strigillata Quadrula metanevra
Quadrula metanevra Quadrula pustulosa
Quadrula pustulosa Pleurobema plenum
Pleurobema plenum Pleurobema gibberum
Pleurobema gibberum Pleurobema cyphyus
Pleurobema cyphyus Pleurobema pyriforme
Pleurobema pyriforme Ptychobranchus subtentum
Ptychobranchus subtentum Villosa taeniata
Villosa taeniata Obliquaria reflexa
Obliquaria reflexa Lemiox rimosus
Lemiox rimosus Hemistena lata
Hemistena lata Lampsilis altilis
Lampsilis altilis Alasmidonta undulata
Alasmidonta undulata
Voir aussi
Articles connexes
Liens externes
- (en) The Mussel Project
- (en) Freshwater Mollusk Conservation Society
- (en) Howard Edlen, Harvesting the River, History of the Pearl Button Business in Meredosia, Illinois
- (en) Référence Fauna Europaea : Unionidae (consulté le )
- (en) Référence BioLib : Unionidae Rafinesque, 1820
- (fr+en) Référence ITIS : Unionidae Rafinesque, 1820
- (en) Référence Animal Diversity Web : Unionidae
- (en) Référence NCBI : Unionidae (taxons inclus)
Bibliographie
- HUFF, S. W., CAMPBELL, D., GUSTAFSON, D. L., LYDEARD, C., ALTABA, C. R., & GIRIBET, G. (2004). Investigations into the phylogenetic relationships of freshwater pearl mussels (Bivalvia: Margaritiferidae) based on molecular data: implications for their taxonomy and biogeography. Journal of Molluscan Studies, 70(4), 379-388.
Notes et références
- World Register of Marine Species (3 février 2009)
- Bieler R., Carter J.G. & Coan E.V. (2010). Classification of Bivalve families. p. 113–133, in: Bouchet P. & Rocroi J.-P. (2010), Nomenclator of Bivalve Families. Malacologia 52(2): 1–184.
- (en) Huber, Markus, Compendium of Bivalves. A Full-color Guide to 3'300 of the World's Marine Bivalves. A Status on Bivalvia after 250 Years of Research, Hackenheim, ConchBooks, , 901 pp. + CD (ISBN 978-3-939767-28-2)
- Coker, R.E. 1919. Fresh-water mussels and mussel industries of the U.S. Bulletin of the Bureau of Fisheries [Issued separately as U.S. Bureau of Fisheries Document 865]. 36(1917–18): 13–89 + 46 plates.
- Cochran, T. G. II, and J. B. Layzer. 1993. Effects of commercial harvest on unionid habitat use in the Green and Barren rivers, Kentucky. In Conservation and Management of Freshwater Mussels. K. S. Cummings, A. C. Buchanan, and L. M. Koch (eds.). Proceedings of a UMRCC symposium, 12–14 October 1992, St. Louis, MO, Upper Mississippi River Conservation Committee, Rock Island, IL, p. 61-65.
- See: MUSSELS: Washboards, Buttons and Pearls, at
- Mouthon, 1982
- Exemple de découverte récente d'une espèce qui était non connue en Tunisie : N. KHALLOUFI & M. BOUMAÏZA ; Première note sur la présence d’Anodonta cygnea (Linnaeus, 1758) (Mollusca, Bivalvia, Unionidae) en Tunisie ; Recibido el 25 de octubre de 2004. Aceptado el 4 de mayo de 2005. (ISSN 1130-4251) (2005), vol. 16, 21-29
- Diversité et communauté divergentes de Moules d’eau douce (Unionidae) de deux rivières adjacente au Parc national Kouchibouguac, Nouveau-Brunswick ; Audrey Beaudet et al. (10 pages, PDF)
- Aldridge, D. C. 2000. The impact of dredging and weed cutting on a population of freshwater mussels (Bivalvia: Unionidae). Biological Conservation , 95: 247-25
- « Résumé d'un article (anglais) sur la toxicité du cuivre pour les larves d'unionidae »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ) ;Peter J. Jacobson et al. ; Sensitivity of glochidial stages of freshwater mussels (Bivalvia unionidae) to copper ; Environmental Toxicology and Chemistry ; 1997 ; DOI:10.1897/1551-5028(1997)016<2384:SOGSOF>2.3.CO;2
- Stephanie E. Goudreau, Richard J. Neves et Robert J. Sheehan ; Effects of wastewater treatment plant effluents on freshwater mollusks in the upper Clinch River, Virginia, USA ; Ed : Springer Netherlands ; (ISSN 0018-8158) (Version imprimée). 1573-5117 (Article Online) ; DOI:10.1007/BF00005471, 211-230 ; 30 septembre 2005 Voir le résumé
- ANTHONY James L. ; DOWNING John A. ; Exploitation trajectory of a declining fauna: a century of freshwater mussel fisheries in North America ; Canadian journal of fisheries and aquatic sciences (ISSN 0706-652X) CODEN CJFSDX ; 001, vol. 58, no10, p. 2071-2090 (2 p. 1/4) Voir Fiche INIST/CNRS
- Williams, J.D., M.L. Warren, Jr., K.S. Cummings, J.L. Harris, and R.J. Neves. 1993. Conservation status of freshwater mussels of the United States and Canada. Fisheries 18(9): 6–22.
- See, Fish & Wildlife Service, Threatened and Endangered Species Listing, at:
- Williams, J. D, M. L. Warren, K. S. Cummings, J. L. Harris, and R. J. Neves, « Conservation Status of Freshwater Mussels of the United States and Canada », Fisheries, vol. 18, no 9, , p. 6–22 (ISSN 1548-8446, DOI 10.1577/1548-8446(1993)018<0006:CSOFMO>2.0.CO;2)
- World Register of Marine Species, consulté le 16 octobre 2019
- Alain BERTRAND, Mulettes et anodontes du Bassin Adour-Garonne : identification, biologie, écologie, conservation, Toulouse, Conservatoire Régional des Espaces naturels de Midi-Pyrénées, , 24 p. (ISBN 978-2-9513828-3-1 et 2-9513828-3-9, lire en ligne)
_Unionidae_Lamiot_Lille_2351.JPG.webp)