Tétraphénylcyclopentadiénone
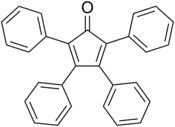
La tétraphénylcyclopentadiénone est un composé aromatique de formule chimique (C6H5)4C4CO. Elle se présente sous la forme d'un solide noir violacé cristallisé soluble dans des solvants organiques. C'est un synthon commode pour de nombreux composés organiques et organométalliques. Elle forme une classe de ligands très étudiée en chimie des organométalliques ; le catalyseur de Shvo, par exemple, utilisé pour certaines hydrogénations, en est un dérivé[3] :
| Tétraphénylcyclopentadiénone | |
| |
| Structure de la tétraphénylcyclopentadiénone | |
| Identification | |
|---|---|
| Synonymes |
Tétracyclone, cyclone |
| No CAS | |
| No ECHA | 100.006.847 |
| No CE | 207-530-3 |
| PubChem | 68068 |
| SMILES | |
| InChI | |
| Apparence | Poudre noire[1] |
| Propriétés chimiques | |
| Formule | C29H20O |
| Masse molaire[2] | 384,468 5 ± 0,024 9 g/mol C 90,6 %, H 5,24 %, O 4,16 %, |
| Propriétés physiques | |
| T° fusion | 217 à 222 °C[1] |
| Précautions | |
| NFPA 704[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Structure
Le noyau C5O de la molécule est plan et conjugué, mais les liaisons ont une nature simple et double définie et alternante. La longueur des liaisons C2–C3 et C4–C5 est de 135 pm tandis que celle des liaisons C1–C2, C3–C4 et C5–C1 est proche de celle de liaisons simples, de l'ordre de 150 pm[4]. Les substituants phényle de la tétraphénylcyclopentadiénone adoptent une configuration en hélice autour du noyau cyclopentadiénone, la rotation de leur plan par rapport à celui du noyau central provenant de la répulsion stérique entre eux[5].
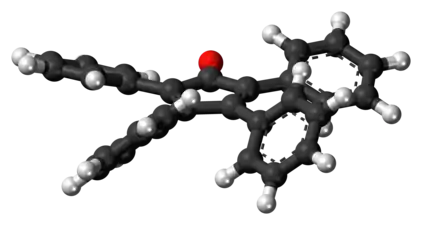 Vue latérale de la molécule.
Vue latérale de la molécule.
La tétraphénylcyclopentadiénone peut être synthétisée par une double crotonisation impliquant du benzile et de la dibenzylcétone en présence d'un catalyseur basique[6] - [7].
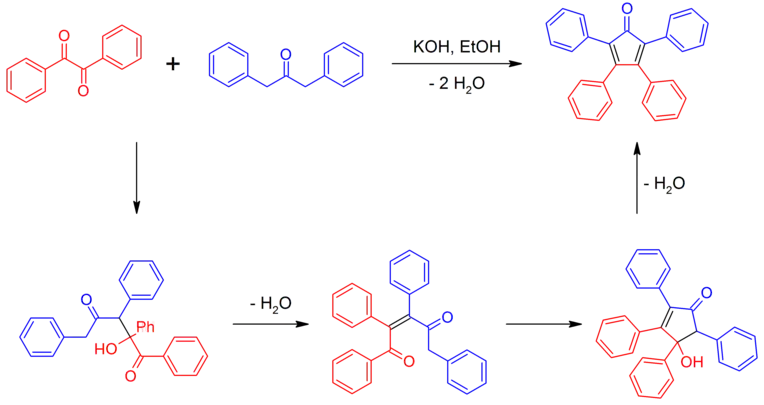 Synthèse de la tétraphénylcyclopentadiénone.
Synthèse de la tétraphénylcyclopentadiénone.
Réactions
Le cycle central agit comme un diène dans les réactions de Diels-Alder avec divers diénophiles. Ainsi, les réactions avec le benzyne conduit au 1,2,3,4-tétraphénylnaphtalène et la réaction avec le diphénylacétylène conduit à l'hexaphénylbenzène[7]. De ce point de vue, c'est un précurseur de molécules de type graphène[8] telles que le coronène.
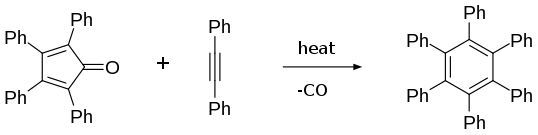 Production d'hexaphénylbenzène avec le diphénylacétylène.
Production d'hexaphénylbenzène avec le diphénylacétylène.
De la même manière, des dérivés de la pentaphénylpyridine peuvent être obtenus par des réactions de Diels-Alder entre la tétraphénylcyclopentadiénone et le benzonitrile.
La tétraphénylcyclopentadiénone peut être une alternative efficace à la DDQ pour l'aromatisation de certaines parties des porphyrines[9] :
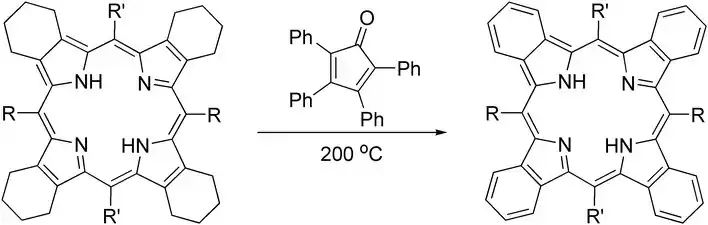 Aromatisation d'une porphyrine.
Aromatisation d'une porphyrine.
Notes et références
- « Fiche du composé Tetraphenylcyclopentadienone, 98% », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Adrien Quintard et Jean Rodriguez, « Iron Cyclopentadienone Complexes: Discovery, Properties, and Catalytic Reactivity », Angewandte Chemie International Edition, vol. 53, no 16, , p. 4044-4055 (PMID 24644277, DOI 10.1002/anie.201310788, lire en ligne)
- (en) J. C. Barnes, W. M. Horspool et F. I. Mackie, « 2,3,4,5-Tetraphenylcyclopenta-2,4-dien-1-one and 5,6,7,8-tetrachloro-3a,9a-dihydro-2,3,3a,9a-tetraphenylcyclopenta[2,3-b][1,4]benzodioxin-1-one-toluene (2/1): compounds of photochemical interest », Acta Crystallographica Section C, vol. C47, , p. 164-168 (DOI 10.1107/S0108270190005145, lire en ligne)
- (en) Curtis F. Sheley et Harold Shechter, « Cyclopentadienones from 1,2,4-cyclopentanetriones, 2-cyclopentene-1,4-diones, and 3-cyclopentene-1,2-diones », The Journal of Organic Chemistry, vol. 35, no 7, , p. 2367-2374 (DOI 10.1021/jo00832a058, lire en ligne)
- (en) John R. Johnson et Oliver Grummitt, « Tetraphenylcyclopentadienone », Organic Syntheses, vol. 23, , p. 92 (DOI 10.15227/orgsyn.023.0092, lire en ligne)
- (en) Louis F. Fieser, « Hexaphenylbenzene », Organic Syntheses, vol. 46, , p. 44 (DOI 10.15227/orgsyn.046.0044, lire en ligne)
- (en) Xinliang Feng, Wojciech Pisula et Klaus Müllen, « Large polycyclic aromatic hydrocarbons: Synthesis and discotic organization », Pure and Applied Chemistry, vol. 81, no 12, , p. 2203-2224 (DOI 10.1351/PAC-CON-09-07-07, lire en ligne)
- (en) Mikhail A. Filatov, Artem Y. Lebedev, Sergei A. Vinogradov et Andrei V. Cheprakov, « Synthesis of 5,15-Diaryltetrabenzoporphyrins », The Journal of Organic Chemistry, vol. 73, no 11, , p. 4175-4185 (PMID 18452337, PMCID 2491715, DOI 10.1021/jo800509k, lire en ligne)

