Aromatisation
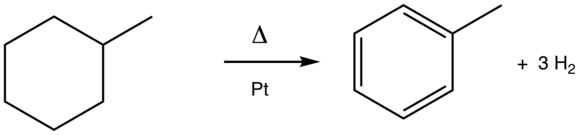
L'aromatisation est une réaction chimique convertissant un composé organique non aromatique en un composé aromatique. Elle est généralement réalisée par déshydrogénation d'un composé cyclique, comme l'illustre la conversion du cyclohexane en benzène. L'aromatisation inclut les composés hétérocycliques[1]. Dans la mesure où l'état d'oxydation des atomes du précurseur s'accroît, il s'agit d'une oxydation. L'aromatisation est généralement thermodynamiquement favorable car elle conduit à la formation d'un système conjugué de faible énergie et stabilisé par mésomérie[2].
Exemples
L'aromatisation est souvent la dernière étape de la synthèse des composés hétéroatomiques, par exemple dans les procédés courants de synthèse des noyaux pyridine, quinoléine, isoquinoléine et indole[4] - [5]. Dans le cas des substitutions électrophiles aromatiques, l'aromatisation se produit comme dernière étape de réaction par clivage d'un proton, comme illustré ci-dessous ; dans la mesure où cette réaction part d'un précurseur déjà aromatique (1) mais passe par un intermédiaire réactionnel non aromatique (2b), on parle de réaromatisation[2] :
 Principe d'une réaromatisation par clivage d'un proton à la suite d'une substitution électrophile aromatique.
Principe d'une réaromatisation par clivage d'un proton à la suite d'une substitution électrophile aromatique.
L'aromatisation peut également résulter d'une déshydrocyclisation d'alcanes[6] ainsi que d'une déshydro-isomérisation, comme celle convertissant le méthylcyclopentane en benzène :
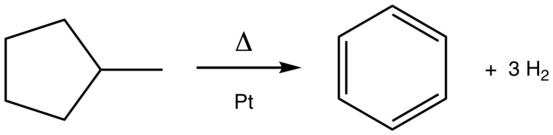 Conversion du méthylcyclopentane en benzène.
Conversion du méthylcyclopentane en benzène.
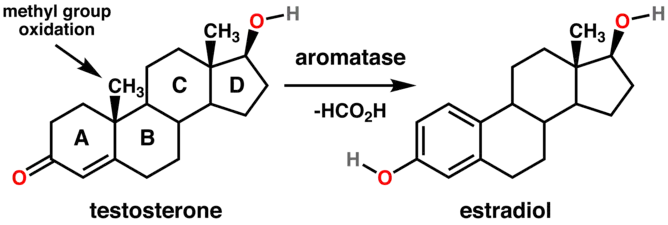
En biochimie, les aromatases sont des enzymes qui assurent l'aromatisation partielle des stéroïdes. Les réactions particulières qu'elles assurent sont la conversion de la testostérone en estradiol et de l'androstènedione en estrone. Ces réactions font intervenir l'oxydation du groupe méthyle en C-19 pour donner de l'acide formique et permettre la formation du système aromatique. Ces conversions sont indispensables à la cancérogenèse par œstrogène dans le développement du cancer du sein et du cancer de l'ovaire post-ménopause chez la femme ou à la suite d'une gynécomastie chez l'homme[7]. Les inhibiteurs de l'aromatase comme l'exémestane, qui forme un lien permanent avec l'enzyme pour l'inhiber[8], ainsi que l'anastrozole et le létrozole, qui sont des inhibiteurs compétitifs[9], se sont montrés plus efficaces que les anti-œstrogènes tels que le tamoxifène probablement parce qu'ils empêchent la formation d'estradiol[7].
Notes et références
- (en) Michael B. Smith et Jerry March, Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 6e éd., 2007, Wiley-Interscience. (ISBN 978-0-471-72091-1)
- (de) Hans Beyer et Wolfgang Walter, Lehrbuch der Organischen Chemie, 24e éd., S. Hirzel, 2004. (ISBN 3-7776-1221-9)
- (en) J. H. Gary et G. E. Handwerk, Petroleum Refining Technology and Economics, 2e éd., Marcel Dekker, 1984. (ISBN 0-8247-7150-8)
- (de) D. T. Davies, Basistexte Chemie: Aromatische Heterocyclen, 1re éd., Wiley-VCH, 1995. (ISBN 3-527-29289-6)
- (en) J. A. Joules et K. Mills, Heterocyclic Chemistry, 5e éd., Blackwell Publishing, Chichester, 2010, p. 125-141. (ISBN 978-1-4051-9365-8)
- (en) Yoshio Ono, « Transformation of Lower Alkanes into Aromatic Hydrocarbons over ZSM-5 Zeolites », Catalysis Reviews, vol. 34, no 3, , p. 179-226 (DOI 10.1080/01614949208020306, lire en ligne)
- (en) Carmen Avendaño et J. Carlos Menéndez, « Chapter 3 - Anticancer Drugs That Inhibit Hormone Action », Medicinal Chemistry of Anticancer Drugs, , p. 53-91 (DOI 10.1016/B978-0-444-52824-7.00003-2, lire en ligne)
- (de) W. Jasek, Austria-Codex, 62e, Österreichischer Apothekerverlag, 2007, p. 656-660. (ISBN 978-3852001814)
- (de) V. Dinnendahl et U. Fricke, Arzneistoff-Profile, vol. 4, 21e éd., Govi Pharmazeutischer Verlag, 2007. (ISBN 978-3774198463)