Tétrafluorure de tellure
Le tétrafluorure de tellure est un composé chimique de formule TeF4. C'est un solide hygroscopique blanc à cristaux incolores qui fond vers 130 °C et se dismute en tellure et hexafluorure de tellure TeF6 à partir de 194 °C :
| Tétrafluorure de tellure | |
| |
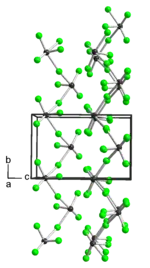
| Structure cristalline du tétrafluorure de tellure __ Te4+ __ F− |
|
| Identification | |
|---|---|
| Synonymes |
fluorure de tellure(IV) |
| No CAS | |
| PubChem | 167258 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | F4Te |
| Masse molaire[1] | 203,59 ± 0,03 g/mol F 37,33 %, Te 62,68 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
À l'état solide, il présente une structure polymérique linéaire de type [–TeF3–F–]n constituée d'octaèdres liés entre eux par des sommets ; un doublet non liant occupe la sixième position de coordination. À l'état liquide, c'est un conducteur de l'électricité. À l'état gazeux, il présente une couleur rouge. Il réagit avec l'eau H2O et la silice SiO2 en formant des oxydes de tellure. Vers 185 °C, il attaque le cuivre, le nickel, le mercure et même l'or[2], mais pas le platine. Il est soluble dans le pentafluorure d'antimoine SbF5 où il forme un précipité correspondant au complexe TeF4SbF5.
Le tétrafluorure de tellure peut être obtenu à partir de dioxyde de tellure TeO2 et de tétrafluorure de soufre SF4 sous pression :
On peut également le préparer de manière semblable avec du tétrafluorure de sélénium SeF4 à 80 °C à la place du tétrafluorure de soufre, ou bien en faisant réagir du fluorure de nitryle NO2F voire du fluor F2 avec du tellure à 0 °C.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Jane Elizabeth Macintyre, Dictionary of Inorganic Compounds, vol. 7, Chapman & Hall/CRC Press, 1992, p. 3195. (ISBN 9780412301209)