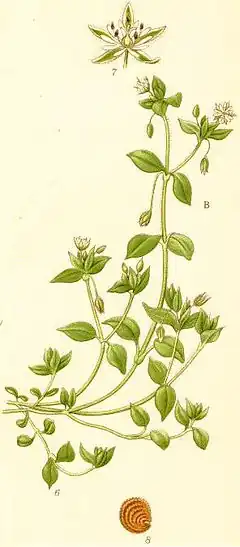
Stellaria media
La Stellaire intermédiaire (Stellaria media L.), également appelée le Mouron blanc ou la Morgeline, est une espèce de plantes annuelles, bisannuelle ou vivace de la famille des Caryophyllaceae. C'est une herbacée commune en Europe et dans une grande partie de l'hémisphère nord. Elle peut faire office de plante bioindicatrice car sa présence est la signature d'un sol équilibré et fertile[1].
Phytonymie et appellations
Le nom du genre vient du latin Stella, l'étoile. Il fait référence aux cinq pétales échancrés qui donnent à la corolle l'aspect d'une étoile à dix rayons. L'épithète du nom botanique media, « milieu », fait référence à la ligne de poils qui court alternativement d'un côté puis de l'autre de chaque entrenœud de la tige ronde, cette caractéristique permettant de la distinguer de plantes toxiques qui affectionnent les mêmes milieux, comme le Mouron rouge[2].
Elle est parfois appelée Mouron blanc ou Mouron des oiseaux. Ce nom vernaculaire vient des graines de la plante, très appréciées par les oiseaux. Celui de Morgeline est une syncope du latin Morsus gallinæ (« morsure des poules »), la volaille des cours de ferme étant avide de cette plante[3].
Pseudo-synonymie
D'autres plantes sont appelées Mouron dont le Mouron rouge (Anagallis arvensis), qui ressemble au Mouron des oiseaux par l'aspect des feuilles et le port de la plante. Voir l'article Mouron.
Description
Appareil végétatif
Cette plante annuelle, bisannuelle ou vivace de 5 à 40 cm de hauteur est très commune, couvrant souvent le sol d'un épais tapis vert. L'appareil souterrain, formé de racines grêles, lui permet de résister au gel. La tige grêle et cylindrique est d'abord étalée (la multiplication végétative se réalisant au niveau des nœuds qui s'enracinent) puis dressée. La tige prostrée se multipliant par bouturage naturel a la capacité de coloniser l'espace à courte distance par reproduction asexuée ou clonale. Ce développement latéral est une stratégie de croissance clonale permettant une certaine mobilité végétative[4]. Si on pince la tige et qu'on tire, on découvre, comme chez la Stellaire graminée, un axe très élastique à l'intérieur. Les petites feuilles (5 à 30 mm de long), entières, pétiolées[5], opposées, d'un beau vert tendre, sont soit sessiles et lancéolées-linéaires, soit à pétiole cilié et limbe ovale, aigu au sommet, mais alors à nervation pennée bien visible uniquement sur la face supérieure de la feuille adulte[6].
En conditions naturelles, sa période de végétation la plus active s'étend de février-mars à novembre, et en condition clémentes elle maintient toute l'année des populations hétérogènes représentées par différentes classes d'âge. En zone tempérée, elle fleurit toute l'année, continue à croître à 2 °C (quand la plupart des plantes sont en dormance)[7], se marcotte spontanément et produit jusqu'à 6 générations par an (espèce polycarpique). L'allélopathie est en outre une composante de la nuisibilité de cette adventice dans certains contextes agricoles où elle se montre très compétitrice (quand elle est en situation de pionnière, sur sol riche et qu'elle dispose d'une quantité suffisante de lumière[8]) ; elle produit des substances phénoliques solubles dans le sol interférant avec les jeunes pousses de blé (Triticum aestivum)[9]. Cette plante comestible a néanmoins longtemps été cultivée et commercialisée.
Appareil reproducteur
La floraison se répartit sur presque toute l'année. L'inflorescence est une cyme bipare qui porte des fleurs de 4 à 6 mm, composées de 5 pétales bifides, blancs, de même longueur que les sépales. L'espèce, hermaphrodite, a un androcée composé de 3 à 8 étamines à anthères rose-rougeâtre, puis brunes. La protandrie favorise une pollinisation entomogame. Le fruit est une capsule ovale dépassant du calice, contenant de nombreuses graines aplaties, brun-rouge ou noires. La dissémination des graines est barochore.
La plante pratique la nyctinastie : la fleur s'ouvre le matin et se ferme complètement le soir ; elle fait de même par temps humide ou très nuageux. La nyctinastie a un impact positif sur la croissance, mais peut, par le processus d'exaptation, jouer un rôle de défense contre les herbivores la nuit, sachant que les principaux consommateurs de ces fleurs, les limaces et les chevreuils, sont surtout actifs de nuit[10].
 Habitus
Habitus.jpg.webp) Fleurs
Fleurs.jpg.webp)
 Stellaria media - Muséum de Toulouse
Stellaria media - Muséum de Toulouse
Habitat et répartition
- Habitat type : cette annuelle commensale des cultures et de l'homme s'épanouit sur les talus, bords de chemins, potagers, dans les champs, dans certains gazons ou prairies... Elle fleurit tant que la température ne descend pas en dessous de 2°C, se développe sur divers types de sols et son optimum de température est 22°C.
- Aire de répartition : Originaire de l'Eurasie (trouvée jusqu'à 4300 m dans l'Himalaya[11]), elle a été introduite en Amérique du nord il y a quelques siècles (notée en 1672[12] et est devenue cosmopolite) Données d'après : Julve, Ph., 1998 ff. - Baseflor. Index botanique, écologique et chorologique de la flore de France. Version : 23 avril 2004.
Utilisations
Usages alimentaires
Comme la Stellaire holostée, les jeunes pousses [13], feuilles et fleurs sont comestibles crues (léger goût de noisette) ou cuites (goût d'épinard).
%252C_NGA_42863.jpg.webp)
Cette espèce ubiquiste et très commune, rencontrée en toute saison, était autrefois cultivée, et il existait jusqu'au début du XXe siècle en France une corporation des marchands de mouron blanc [14]. C'était un des cris de Paris les plus fréquents.
C'est l'une des meilleures salades sauvages : douce, non amère et renfermant calcium, silice, magnésium, vitamine C. Au Japon, elle fait partie de la traditionnelle salade en début d'année : la salade aux 7 herbes (voir la fête du Nanakusa-no-sekku). Elle est aussi consommée en soupe (par exemple hachée et mixée avec eau, huile d’olive, ail et pommes de terre), intégrée dans les pâtes à crêpe ou des smoothies [15] et des farces de ravioli[16]. Les tiges deviennent plus filandreuses avec l'âge.
On peut aussi consommer ses minuscules graines [17].
Comme les pissenlits et d'autres composées, elle peut causer des irritations chez certains allergiques[18]. Elle est diurétique (et laxative si consommée en grande quantité) ; légèrement toxique en raison de sa concentration en saponines [19]. Cette toxicité persiste en partie après dessiccation. Cette plante n'est pas appétente pour de nombreux animaux et consommée par d'autres (les oiseaux apprécient notamment ses graines). En contexte d'agriculture intensive (apports d'engrais, ensilage) cette plante nitrophile accumule des nitrates (à des taux dangereux pour le bétail selon A. Case en 1957[20] mais cette conclusion a été contredite par des études postérieures[21]).
En période de disette ou de famine, elle constituait dans les campagnes un aliment de complément pour faire face aux difficultés et aux menaces de disette (c'est une des explications possible de l'expression « se faire du mouron »), mais consommée en trop grande quantité, elle provoquait des diarrhées. En voici deux exemples :
- Un sou par-là, deux sous par-ci ! La bonne femme dit merci. C’est avec les gros sous de cuivre Que l’on achète de quoi vivre, Et qu’elle, la peau sur les os, Peut donner, à l’heure où l’on dîne, À son bambin, à sa bambine, Du mouron pour les p’tits oiseaux ! — (Jean Richepin, La Chanson des gueux, 1881, pages 101-103).
- Dans le film Little Palestine : journal d'un siège (celui d'une ville syrienne de 2013 à 2015), une scène montre une petite fille palestinienne expliquer pourquoi elle cueille à longueur de journée des feuilles de mouron.
Cette plante ne doit pas être consommée si elle a poussé sur des sols pollués, car elle présente une certaine tolérance à certains métaux toxiques qu'elle peut alors bioaccumuler. Elle remplit par exemple presque les critères d'hyperaccumulateur de cadmium, qui est un contaminant de certains engrais et lisiers. Ce fait permettrait de l'utiliser en bioremédiation, même en hiver pour décontaminer certains sols. Sa taille, sa biomasse et sa croissance sont réduites quand la pollution augmente, mais sans autres marques visibles de stress[22]. Des chercheurs ont réussi à extraire via les pousses de mouron blanc jusqu'à 87,42 μg (max) par plant pour un sol contenant 100 mg de cadmium par kg[22].
Usages médicinaux
Les pharmacopées traditionnelles, notamment asiatique et indo-européenne, lui ont attribué — tout comme à la Stellaire holostée — de nombreuses propriétés :
- toniques ;
- diurétiques[23] ;
- expectorantes[23] (en infusion), anxiolytiques[23] et anti-asthmatiques[23] ;
- légèrement laxative ;
- anti-inflammatoires[24] utilisées sous forme de pâte de feuilles contre les inflammations des voies digestives, rénales, respiratoires et reproductives[25], contre les hémorroïdes[23], l'inflammation de l'œil[23] et divers types de démangeaisons cutanées[26] - [27] et contre l'eczéma[24] ;
- contre les enflures[25], fractures[25] - [28] - [29] en application externe (emplâtres, pâte de feuilles...), contre les brûlures[30], certaines blessures, piqûres d'insectes, certaines affections articulaires[26] (et en décoction contre les douleurs articulaires)[23] ;
- contre certaines maladies nerveuses[24] ;
- contre certains maladies du sang[24].
Les graines réduites en poudre, mélangées à du lait, soignent les infections cutanées et les allergies[30].
Chez les Indiens d'Amérique du Nord, la pâte de feuilles apaisait la toux, le rhume et le mal de gorge[31] et selon FK Fitzpatrick en 1954, la plante améliore l'immunité contre certains pathogènes respiratoires (Mycobacterium tuberculosis)[32].
S. media contient des acides phénoliques et des flavonoïdes[33], des C-glycosyl flavones[34], des saponines triterpénoïdes[35], un pentasaccharide[36], des lipides[37] et des constituants aqueux[38]. Une grande partie de ces composés chimiques sont retrouvés dans d'autres plantes du même genre (120 espèces environ, dont plusieurs ont des usages phytopharmaceutiques reconnus)[39].
Une étude récente (2012) sur le modèle animal (souris) confirme des vertus anxiolytiques en particulier sous forme d'extrait par le méthanol ; comparable à l'effet du diazépam pour une dose de 100 mg/kg [24] même si le mécanisme n'est pas encore compris. Les auteurs montrent que cet extrait contient des flavonoïdes, des triterpénoïdes, des protéines, des tanins, de glucides et lipides[24].
Un extrait de cette plante contenant des flavones glycosylées a un effet hypolipémiant, d'où l'hypothèse que ces composés pourraient servir d'agent amaigrissant [40].
Ils ont également des propriétés antivirales et antitumorales [41].
Selon une étude russe (2013), chez le rat de laboratoire, la fraction des polysaccharides hydrosolubles (à 100 mg/kg) s'est montré protectrice du foie de rats atteints d'hépatite induite par le CCl4[42].
Dans les années 2010, son potentiel photochimique et phytopharmaceutique, et celui de ses proches parentes fait encore l'objet de recherches[39]
Alimentation animale
Les parties aériennes de S. neglecta ont été utilisées en élevage pour les volailles et le bétail (jugées «rafraîchissantes» pour le bétail en Italie du Sud)[43].
Les graines de la plante sont très appréciées par les oiseaux, y compris la volaille des cours de ferme.
Plante-hôte
La chenille du lépidoptère appelé Brocatelle d'or (Camptogramma bilineata) se nourrit notamment de Mouron des oiseaux.
Résistance aux pesticides
Elle fait partie des plantes dont certains biotypes ont développé des résistances croisées à certaines désherbants (chlorsulfuron, triazolopyrimidine)[44], Mécoprop[45], Oxyfluorfen[46] sulfonylurées[47]
Références
- « Comprendre son sol avec les plantes bio-indicatrices - Ferme de Sainte Marthe », sur www.fermedesaintemarthe.com (consulté le )
- François Couplan, Les plantes et leurs noms. Histoires insolite, Éditions Quae, (lire en ligne), p. 86.
- Alexandre de Théis, Glossaire de botanique, G. Dufour et Cie, (lire en ligne), p. 18.
- (en) Tomáš Herben, František Krahulec, Věra Hadincová & Sylvie Pecháčková, « Is a grassland community composed of coexisting species with low and high spatial mobility ? », Folia Geobotanica & Phytotaxonomica, vol. 29, no 4, , p. 459-468.
- Les pétioles sont plus longs sur feuilles du bas.
- François Couplan, Eva Styner, Guide des plantes sauvages comestibles et toxiques, Delachaux et Niestlé, , p. 38.
- Turkington R, Kenkel N.C & Franko G.D (1980) The Biology of Canadian Leeds : 42. Stellaria media (L.) Vill. Canadian Journal of Plant Science, 60(3), 981-992.
- Van Delden, A., Lotz, L. A. P., Bastiaans, L., Franke, A. C., Smid, H. G., Groeneveld, R. M. W., & Kropff, M. J. (2002). The influence of nitrogen supply on the ability of wheat and potato to suppress Stellaria media growth and reproduction. Weed Research, 42(6), 429-445 (résumé).
- (en) KMM Dakshini, « Allelopathic interference of chickweed, Stellaria media with seedling growth of wheat (Triticum aestivum) », Revue canadienne de botanique, vol. 76, , p. 1317-1321 (DOI 10.1139/b98-159).
- (en) Pavol Prokop, Peter Fedor, « Why do flowers close at night? Experiments with the Lesser celandine Ficaria verna Huds (Ranunculaceae) », Biological Journal of the Linnean Society, vol. 118, no 3, , p. 698-702 (DOI 10.1111/bij.12752).
- Ankei T (1982) Habitat gradient and reproductive habits of the seven Stellaria species in Japan, Bot Mag Tokyo, 94, 35-48.
- Josselyn cité par Rousseau C (1968) in Histoire, habitat et distribution de 220 plantes introduites au Québec. Natur. Can. 95: 49-17l.
- Éviter les tiges rasant le sol car elles ont un goût terreux.
- Philippe Jauzein, Olivier Nawrot et Gérard Aymonin, Flore d'Ile-de-France, Quae, , p. 179.
- ex : Mixage dans un blender de trois poires bien mûres, une pomme, deux poignées de stellaire, une petite poignée de mâche et un verre d'eau.
- "Recettes avec des plantes sauvages" - Myriam de Mahé - Éditions Le mercure dauphinois - 2009
- François Couplan, Eva Styner, Guide des plantes sauvages comestibles et toxiques, Delachaux et Niestlé, , p. 39.
- Jovanović, M., Poljački, M., Mimica‐Dukić, N., Boža, P., Vujanović, L. J., Ðuran, V., & Stojanović, S. (2004) Sesquiterpene lactone mix patch testing supplemented with dandelion extract in patients with allergic contact dermatitis, atopic dermatitis and non‐allergic chronic inflammatory skin diseases. Contact dermatitis, 51(3), 101-110.
- (en) Anupam Sharma & Disha Arora, « Phytochemical and Pharmacological Potential of Genus Stellaria : A Review », Journal of Pharmacy Research, vol. 5, no 7, , p. 3593 (lire en ligne).
- Case A.A (1957) Some aspects of nitrate intoxication in livestock. J. Amer. Vet. Med. Assoc. 130:323
- Davison K.L, Hansel W.M, Krook L, McEntee K & Wright M.J (1964) Nitrate toxicity in dairy heifers. I. Effects on reproduction, growth, lactation, and vitamin A nutrition. Journal of Dairy Science, 47(10), 1065-1073.
- Lin L.J & al. (2014) Cadmium accumulation characteristics of winter farmland weed Stellaria media. Ecology and Environmental Sciences, 23, 673-678 (résumé).
- Anonymous (1976) The Wealth of India. Publications and Information Directorate, CSIR, Vol X. New Delhi;. p. 39-40.
- Arora D & Sharma A (2012) Evaluation of anxiolytic activity of Stellaria media Linn. extracts in mice. Phcog Comm, 2, 58-61.
- Duke JA. (1985) CRC Handbook of Medicinal Herbs. Florida: CRC Press; p. 458.
- Paul Fournier, Le livre des plantes médicinales et vénéuses de France, P. Lechevalier, , p. 454.
- Shan Y, Zhou J, Zhao HG, Feng X, Dong Y, Xia B, et. al. (2010) Amino acid and mineral composition of Stellaria media. Chem Nat Compd ; 46(4): 667-668.
- Shinwari MI, Khan MA (2000) Folk use of medicinal herbs of Margalla Hills National Park, Islamabad, J Ethnopharmacol, 69, 45- 56.
- Ahmad SS, Husain, SZ (2008) Ethno medicinal survey of plants from salt range (Kallar Kahar) of Pakistan, Pak J Bot, 40, 1005- 1011.
- Malik AH, Khuroo AA, Dar GH, Khan ZS (2011) Ethnomedicinal uses of some plants in the Kashmir Himalaya, Ind J Tradit Know, 10, 362- 366.
- Scully V (1960) A Treasury of American Indian Herbs, Bonanza Books, New York, 210-213
- Fitzpatrick FK (1954), Plant substances achieve against Mycobacterium tuberculoses, Antibiotics and Chemotherapy, Vol 4.
- Kitanov G (1992) Phenolic acids and flavonoids from Stellaria media (L.) Vill. (Caryophyllaceae). Pharmazie.; 47(6): 470-471.
- Yong-Mei H, Wen-Cai Y, Qian L, Hai-Yan T, Hao W, Hong-Yu D (2006) C- Glycosylflavones from Stellaria media. Zhongguo Tianran Yaowu.; 4(6): 420- 424.
- Hodisan V, Sancraian A (1989) Triterpenoid saponins from Stellaria media (L.) Cyr. Farmacia.; 37(2): 105-109.
- Vanhaecke M, Van den Ende W, Lescrinier E, Dyubankova N (2008) Isolation and characterization of a pentasaccharide from Stellaria media. J Nat Prod.; 71(11): 1833-1836.
- Pande A, Shukla YN, Tripathi AK (1995) Lipid constituents from Stellaria media. Phytochemistry.; 39(3): 709-711
- Hu Y, Wang H, Ye W, Liu G (2005) Aqueous constituents from Stellaria media (L.) Cyr. Zhongguo Yaoke Daxue Xuebao ; 36(6): 523-525.
- Sharma A & Arora D (2012) Phytochemical and pharmacological potential of genus Stellaria: a review. J Pharma Res, 5(7), 3591-3596.
- (en) Lou J, Zhang L, Zhang X (2004) Production method, use and preparation of chickweed total flavones, Faming Zhuanli Shenqing Gongkai Shuomingshu
- Anupam Sharma, op. cit., p. 3596
- Gorina Y.V, Saprykina E.V, Gereng E.A, Perevozchikova T.V, Krasnov E.A, Ivanova E.V, ... & Baranova O.V (2013) Evaluation of hepatoprotective activity of water-soluble polysaccharide fraction of Stellaria media L. Bulletin of experimental biology and medicine, 154(5), 645-648.
- Motti R, Antignani V, Idolo M, Traditional Plant Use in the Phlegraean fields regional park (Campania, Southern Italy), Hum Ecol, 37, 2009, 775–782.
- Hall L.M & Devine M.D (1990) Cross-resistance of a chlorsulfuron-resistant biotype of Stellaria media to a triazolopyrimidine herbicide. Plant physiology, 93(3), 962-966.
- Coupland, D., Lutman, P. J., & Heath, C. (1990) Uptake, translocation, and metabolism of mecoprop in a sensitive and a resistant biotype of Stellaria media. Pesticide Biochemistry and Physiology, 36(1), 61-67 (résumé).
- Matsumoto, H., Kashimoto, Y., & Warabi, E. (1999) Basis for common chickweed (Stellaria media) tolerance to oxyfluorfen. Pesticide biochemistry and physiology, 64(1), 47-53.
- Kudsk, P., Mathiassen, S. K., & Cotterman, J. C. (1995) Sulfonylurea resistance in Stellaria media [L. Vill]. Weed research, 35(1), 19-24.
Voir aussi
Articles connexes
Liens externes
- (fr) Référence Belles fleurs de France : Stellaria media
- (en) Référence Flora of North America : Stellaria media
- (en) Référence Flora of China : Stellaria media
- (en) Référence Flora of Missouri : Stellaria media
- (en) Référence Catalogue of Life : Stellaria media (L.) Vill. (consulté le )
- (fr+en) Référence ITIS : Stellaria media (L.) Vill.
- (en) Référence NCBI : Stellaria media (taxons inclus)
- (en) Référence GRIN : espèce Stellaria media (L.) Vill.
- (fr) Référence Tela Botanica (France métro) : Stellaria media (L.) Vill.
- (fr) Référence Tela Botanica (Antilles) : Stellaria media (L.) Vill.
- (fr) Référence INPN : Stellaria media (L.) Vill., 1789 (TAXREF)
Bibliographie
- Baskin, J. M., & Baskin, C. C. (1979) Promotion of germination of Stellaria media seeds by light from a green safe lamp. New Phytologist, 82(2), 381-383.
- Grundy, A. C., Phelps, K., Reader, R. J., & Burston, S. (2000) Modelling the germination of Stellaria media using the concept of hydrothermal time. New Phytologist, 148(3), 433-444 (résumé).
- Lutman P.J.W (2002) Estimation of seed production by Stellaria media, Sinapis arvensis and Tripleurospermum inodorum in arable crops. Weed Research, 42(5), 359-369.
- Newcomb, W., & Fowke, L. C. (1974) Stellaria media embryogenesis: the development and ultrastructure of the suspensor. Canadian Journal of Botany, 52(3), 607-614 (résumé).
- Pande, A., Shukla, Y. N., & Tripathi, A. K. (1995) Lipid constituents from Stellaria media. Phytochemistry, 39(3), 709-711 (résumé).
- Pritchard H.N (1964) A cytochemical study of embryo development in Stellaria media. American Journal of Botany, 51(5), 472-479 (résumé).
- Pritchard, H. N. (1964) A cytochemical study of embryo sac development in Stellaria media. American Journal of Botany, 51(4), 371-378 (résumé).
- Van der Vegte, F. W. (1978) Population differentiation and germination ecology in Stellaria media (L.) Vill. Oecologia, 37(2), 231-245 (résumé).