Spectrophotométrie d'émission de flamme
En chimie analytique, la spectrophotométrie d'émission de flamme ou plus simplement spectrométrie d'émission de flamme[1] (en anglais : flame emission spectroscopy) est une technique de spectroscopie d’émission atomique utilisée pour la quantification des métaux à l’état de traces ou non et est particulièrement utile pour l’analyse dans des matrices biologiques, telles que le sérum et l'urine[2].
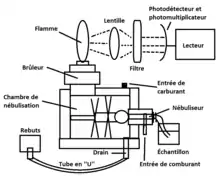
Composantes d'un appareil
Injecteur

L’injecteur est la partie par laquelle l’échantillon est introduit. On parle d’un injecteur automatique lorsque l’on ajoute un carrousel et un programme de lecture automatique. L’injection se fait par un capillaire qui est relié au nébuliseur. Il forme un T et possède deux entrées : l’une d'elles sert à faire pénétrer le gaz comburant et la seconde sert pour l’introduction de l’échantillon. Comme il n'y a pas de pompe dans l'appareil, c’est l’effet Venturi qui introduit l’échantillon. Cet effet est dû à l’introduction d’un débit gazeux dans la première entrée et induit une pression négative dans la seconde entrée ce qui fait pénétrer le mélange aqueux dans l’instrument. La nébulisation dite « pneumatique » rend l'échantillon sous forme d'aérosol dû à la haute vélocité du gaz comburant[3] - [4].
Chambre de nébulisation
La chambre de nébulisation est l'endroit où l'échantillon aqueux sera séparé en petites gouttelettes, étapes importantes pour la quantification des métaux. La chambre de nébulisation est présente pour un photomètre à émission de flamme ayant un brûleur à prémélange. La chambre peut contenir une bille d’impact et/ou des hélices. La bille d’impact est généralement conçue en Téflon et est donc très résistante à la détérioration chimique. Elle peut aussi être conçue en verre, ce qui rend la bille plus dure mais moins résistante aux résidus fluorés. Celle-ci est placée directement à l’entrée de la chambre de nébulisation, de manière que les gouttes de l’échantillon entrant dans le système soient projetées et fragmentées en de plus petites gouttelettes. Les gouttes grossières sont acheminées hors du système par un drain, afin que seules les petites gouttelettes se rendent à la flamme. Il est estimé que 5 % de l'échantillon atteint la flamme qui suit. On peut également avoir un système d’hélices. Ce sont des hélices qui tournent rapidement et qui empêchent le passage des plus grosses gouttes (supérieures à vingt micromètres). Dans le cas d'un système à prémélange, les hélices servent également à bien mélanger les combustibles et le mélange analytique dans la chambre de nébulisation. Le fait d'avoir une bille d’impact ainsi que les hélices permet d’avoir un mélange et une détection optimale[5].
Drain
Les grosses gouttes qui ne réussissent pas à continuer dans le système se retrouvent dans le drain, qui se trouve au fond de la chambre de nébulisation. Le drain laisse place à un système de tube en « U » avant d'être relié aux rebuts. Dans ce système, une partie du liquide drainé reste dans la partie la plus basse du tube. Cela empêche les gaz explosifs de remonter dans les rebuts et de créer un possible accident[4].
Tête du brûleur
Il existe deux types de brûleur pour le photomètre de flamme à émission atomique. Le premier étant un brûleur à prémélange et le second étant un brûleur à combustion totale[6] - [4].
Brûleur à prémélange
Dans un brûleur à prémélange, l’addition du comburant se fait dans la chambre de nébulisation afin d’optimiser le mélange combustibles/analytes. C'est le type de brûleur qui est le plus utilisé, car il permet une homogénéisation optimale et offre donc de meilleurs résultats[4] - [6].
Brûleur à combustion totale
Dans le brûleur à combustion totale, l'appareil est différent, car il n'y a pas de chambre de nébulisation proprement dite. Il est composé d’un capillaire d’aspiration et de deux entrées de gaz (comburant et carburant). Grâce à l'effet Venturi, l’échantillon est aspiré vers le haut du capillaire, puis dans la flamme. En arrivant dans le haut du capillaire, l’échantillon contenu dans la matrice se fragmente en de petites gouttes qui peuvent ensuite se désolvater et s’atomiser dans la flamme. Contrairement à un brûleur à prémélange, tout l'échantillon est consommé par la flamme[4] - [6].
Flamme et mélange gazeux
Le spectrophotomètre de flamme utilise un mélange gazeux pour entretenir une flamme, qui est la source d’excitation de l’appareil. Une caractéristique pour une bonne flamme est d’avoir une température assez élevée pour être en mesure d’exciter les ions métalliques qui proviennent de l’échantillon. Il est primordial d’avoir un système qui régularise le débit entrant du mélange gazeux, car une fluctuation peut entraîner un changement de température de la flamme et ainsi changer la quantité d’excitations de l’échantillon. Les résultats seraient biaisés[7].
| Mélange gazeux | Température d’ignition
(°C) |
Température approximative de la flamme
(°C) |
| H2 - Air | 530 | 2 045 |
| H2 - O2 | 450 | 2 660 |
| H2 - N2O | - | 2 690 |
| Acétylène - Air | 350 | 2 400 |
| Acétylène - O2 | 335 | 3 140 |
| Acétylène - N2O | 400 | 2 800 |
Ces mélanges gazeux procurent une température assez élevée pour exciter les ions métalliques. Par conséquent, un mélange offrant une température de flamme plus élevée sera susceptible d'exciter plus d'ions. Cela peut entraîner une limite de détection et de quantification plus basse, mais peut aussi augmenter la vitesse à laquelle l'instrument sature[7].
| Élément | Acétylène/Air
(%) |
Acétylène/O2
(%) |
Acétylène/N2O
(%) |
| Lithium | 0,01 | 16,1 | -[8] |
| Sodium | 1,1 | 26,4 | - |
| Potassium | 9,3 | 82,1 | - |
| Rubidium | 13,8 | 88,8 | - |
| Césium | 28,6 | 96,4 | - |
| Magnésium | - | 0,01 | 6 |
| Calcium | 0,01 | 7,3 | 43 |
| Strontium | 0,010 | 17,2 | 84 |
| Baryum | 1,9 | 42,3 | 88 |
| Manganèse | - | - | 5 |
Système de détection
Le principe de détection est comme pour plusieurs appareils. En émission de flamme, on mesure les photons émis par les atomes excités qui retournent à l’état fondamental. Les photons provenant des ions métalliques dans la flamme sont dirigés vers une lentille qui les converge vers un monochromateur. Le monochromateur d’un photomètre de flamme est sous forme d’un filtre. Ce dernier laisse passer la longueur d’onde désirée. Le filtre est choisi en fonction du métal à analyser. Les métaux ont une longueur d’émission majeure propre[9] - [7].


| Élément | Longueur d’onde d’émission
(nm) |
Couleur de la flamme |
| Sodium | 589 | Jaune |
| Potassium | 766 | Violet |
| Baryum | 554 | Vert |
| Calcium | 622[11] | Orange |
| Lithium | 670 | Rouge |
La lumière passe ensuite au détecteur, qui est sous forme de photodiode et de photomultiplicateur. La lumière entrante excite un métal dans la photodiode qui expulse des électrons. Ces derniers sont attirés par un champ électrique vers une dynode. L’impact des électrons déloge deux autres électrons ou plus qui se dirigent vers une autre dynode. Le phénomène se produit plusieurs fois dans le but d’amplifier le signal électrique. Les électrons se dirigent vers le système de traitement des données[10].
Principe
La méthode consiste à chauffer les ions métalliques d'un échantillon dans le but de capter les émissions lumineuses provenant de leur excitation à l'aide d'un détecteur. Ainsi, un système avec un gaz vecteur emporte l'échantillon nébulisé dans une flamme, où le processus d'excitation a lieu. Comme dans plusieurs méthodes analytiques, il doit y avoir un système d'étalonnage pour quantifier la présence d'un métal dans un échantillon[3] - [5] - [6].
Principe d'atomisation
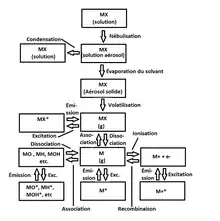
Soit M le cation métallique et X son contre-anion. Le processus d’atomisation débute lorsque l’analyte nébulisé (MX- aérosol) entre dans la flamme contenue dans l’instrument.
- La première étape consiste à l’évaporation du solvant. La flamme fera complètement évaporer le solvant pour ne laisser que de fines particules de l’analyte sous forme solide (MX - aérosol solide).
- La deuxième étape consiste à la volatilisation de l’analyte solide. Par conséquent, l’analyte passera de l’état solide à gazeux (MX - gaz).
À ce stade-ci, il peut se passer deux phénomènes :
- le premier étant l’excitation de la molécule (MX*) ;
- le second étant la dissociation du sel (M(g) + X(g)).
À ce stade-ci, il est possible d'observer trois phénomènes :
- le premier est celui recherché, c’est-à-dire l’excitation du métal gazeux (M*) ;
- le deuxième est l’ionisation du métal gazeux. Cela implique que le métal absorbe assez d’énergie lors de son excitation pour expulser complètement un électron de valence (M+ + e−). À son tour, cet ion peut être excité (M+*) ;
- le troisième est l’association du métal gazeux à un autre atome ou molécule à l’état gazeux (ex. : MOH). À son tour, cette molécule peut être excitée (MOH*).
Dans le deuxième et troisième cas, les longueurs d'onde d'émission sont différentes du premier cas, ce qui ne fait pas d'interférence. Dans certains cas, il est préférable de mesurer la longueur d'onde d'émission de l'ion excité ou de la molécule associée excitée, car le signal est plus intense. C'est le cas du calcium[2] - [6].
Principe d'excitation d'une molécule ou d'un atome

Lors de l’atomisation d’un sel métallique (par exemple), on observe l’excitation de celui-ci. Le phénomène se traduit par le déplacement d’un électron de valence vers une orbitale plus énergétique. Comme l’état excité est énergétiquement peu stable et que l’énergie fournie par la flamme n’est plus assez élevée dû au fait que l'espèce atomisée s’éloigne du point de chaleur maximale, l’espèce retourne à son état fondamental. Le déplacement de l’électron vers son orbitale initiale engendre un dégagement d’énergie. Cette dernière est émise sous forme d’un photon, dont la longueur d’onde λ dépend du niveau énergétique de l’électron qui retourne à l’état fondamental. L’électron en question peut cependant passer à des orbitales intermédiaires avant de revenir à son orbitale initiale. Cela engendre l’émission de photons plus ou moins énergétiques[2] - [7].
- M(g) + énergie → M*
- M* → M(g) + λ
Préparation de l'échantillon
- Avant d’être introduit dans le photomètre de flamme, un échantillon doit être « digéré » ; ce terme signifie qu’il faut que l’analyte recherché soit sous forme ionique aqueux et pour ce faire, on utilise un acide. Il faut s’assurer que l’acide utilisé dissolve bien l’analyte. On utilise souvent l’acide nitrique, car c’est aussi un oxydant capable de bien dissocier le métal voulu, dû à son potentiel d'oxydoréduction. On utilise aussi l’acide sulfurique, l’acide acétique, ainsi que l’acide chlorhydrique. L’acide peut être corrosif également pour l’instrument ; ainsi, la concentration en acide de la matrice doit être inférieure à 2 %.
- Une autre étape pour la préparation de l’échantillon est sa dilution : il doit être convenablement dilué[12] afin que sa concentration en métaux fasse partie de la courbe d’étalonnage[10].
Cheminement de l'échantillon dans un appareil
Grâce à une entrée d’air située au début de l’instrument et à l’effet Venturi, l’échantillon est aspiré par le tube. L’échantillon est projeté sur la bille d’impact, ce qui crée de petites gouttelettes. Dans le cas d’un brûleur à prémélange, l’entrée des gaz se situe dans la chambre de nébulisation. Le gaz et les gouttelettes sont donc mélangés. La totalité de l’échantillon ne se rend pas vers le brûleur. Le reste, soit les plus grosses gouttes qui se frappent sur les parois ou sur les hélices, va dans le drain. Les gouttelettes vont dans le brûleur, où se trouve la flamme. À cet endroit, le mélange de gaz brûle tandis que les ions métalliques sont atomisés et subissent le processus d’excitation. La lumière émise par ce dernier est dirigée vers une lentille qui la converge vers le filtre. Ce dernier, qui est choisi par l'analyste en fonction du métal à quantifier, laisse passer la lumière à une longueur d’onde précise. Cette lumière atteint un photodétecteur et photomultiplicateur pour ensuite afficher les résultats à un système de lecture[10].
Compétition avec d'autres techniques instrumentales
Le photomètre à émission de flamme est moins utilisé, car les appareils d'absorption atomique offrent une meilleure précision et une limite de détection plus basse. Dans le cas d'un échantillon multi-élémentaire, les instruments avec source au plasma (ICP) sont plus efficaces[9].
Avantages
- Les longueurs d’onde utilisées pour l’analyse des métaux sont différentes et distinctes, n’engendrant pas d’interférence entre métaux[10].
- Les gaz utilisés pour la flamme sont moins dispendieux que ceux d’un ICP qui fonctionne aussi par émission de flamme.
- L'appareil est utile pour les métaux ayant une température d'excitation relativement basse, soit les métaux alcalins et certains alcalino-terreux.
Inconvénients
- L'instrument peut être utilisé pour l’analyse d’un nombre limité de métaux, dû à la basse température de la flamme.
- L’appareil peut bloquer au niveau de l’introduction s’il y a présence de particules en suspension dans la solution analysée.
- Il est impossible de faire la lecture de deux métaux de façon simultanée.
Notes et références
- ISO 6955:1982(fr) Méthodes d'analyse par spectroscopie — Émission de flamme, absorption atomique et fluorescence atomique — Vocabulaire.
- Skoog, Holler et Nieman (trad. de l'anglais), Principes d'analyse instrumentale, Paris/Bruxelles, De Boeck, , 250-251 p. (ISBN 2-7445-0112-3).
- James W. Robinson, Eileen M. Skelly Frame et George M. Frame II, Undergraduate instrumental analysis, Marcel Dekker, , 6e éd.
- Mavrodineanu, Boiteux, Radu, Henri, Flame Spectroscopy, John Wiley & Sons, .
- Wood Ewing, Galen, Analytical instrumentation Handbook 2nd Edition, Revised and extended, Marcel Dekker, .
- Charles K., Thomas J. Vickers et Wilson M. Gullick, Instrumental Analysis, Harper & Row, .
- Hobart, Lynne, John, Frank H. Williard, L. Merrit, A. Dean, A. Settle, Instrumental Methods of Analysis, Wasworth, (ISBN 0-534-08142-8).
- Tiret : valeur non déterminée.
- Douglas, James, Stanley R. Skoog, Holler, Crouch, Principes of Instrumental Analysis, Thomson Brooks/Cole, , 6e éd., 1039 p. (ISBN 978-0-495-01201-6 et 0-495-01201-7).
- « Flame Photometer Models PFP7 and PFP7/C » [PDF], sur www.jenway.com, .
- Le calcium émet une longueur d’onde à 423 nm, mais lors du processus d’atomisation, c’est majoritairement l'hydroxyde de calcium (Ca(OH)2) qui est excité et a une longueur d’onde d’émission de 622 nm.
- Par exemple, taux de 100:1 pour un échantillon de sérum.