Séléniure de mercure
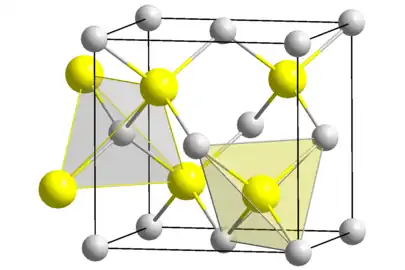
Le séléniure de mercure, ou séléniure de mercure(II), est un composé chimique de formule HgSe. Il se présente sous la forme d'un solide gris anthracite de structure blende aux cristaux brillants d'apparence métallique. Il existe dans le milieu naturel sous la forme d'un minéral appelé tiemannite. Sa structure cristalline appartient au système cubique, groupe d'espace F43m (no 216), avec comme paramètre cristallin a = 607 pm[3]. Il adopte une structure de type cinabre à partir de 0,75 GPa, puis halite à partir de 16 GPa et du système tétragonal au-dessus de 28 GPa[4].
| Séléniure de mercure | |||
| |||
| __ Hg2+ __ Se2− Structure cristalline du séléniure de mercure |
|||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No ECHA | 100.039.903 | ||
| No CE | 243-910-5 | ||
| PubChem | 88609 | ||
| SMILES | |||
| InChI | |||
| Apparence | solide gris inodore[1] | ||
| Propriétés chimiques | |||
| Formule | HgSe |
||
| Masse molaire[2] | 279,55 ± 0,05 g/mol Hg 71,76 %, Se 28,25 %, |
||
| Propriétés physiques | |||
| T° fusion | 600 à 650 °C[1] | ||
| Masse volumique | 8,266 g/cm3[1] | ||
| Précautions | |||
| SGH[1] | |||
   Danger |
|||
| NFPA 704[1] | |||
| Transport[1] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Il peut être obtenu par une réaction en plusieurs étapes d'acide nitrique HNO3 avec du sélénium, de l'oxyde de mercure(II) HgO et du sulfate d'hydrazine N2H6SO4[5] :
- 3 HgO + 3 Se + 4 HNO3 ⟶ 3 HgSeO3 + 4 NO + 2 H2O ;
- 2 HgSeO3 + 3 N2H6SO4 + 6 NH3 ⟶ 2 HgSe + 3 N2 + 3 (NH4)2SO4 + 6 H2O.
Il est également possible de procéder à partir des éléments à environ 600 °C :
Ses propriétés électroniques sont celles d'un semimétal.
Notes et références
- « Fiche du composé Mercury(II) selenide, 99.999% (metals basis) », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Otfried Madelung, Semiconductors: data handbook, Springer, Berlin Heidelberg, 2004, p. 239. (ISBN 978-3-540-40488-0)
- (en) Sadao Adachi, Handbook on physical properties of semiconductors, Kluwer Academic Publishers, 2004, p. 420 sqq. (ISBN 978-1-4020-7820-0)
- (de) Georg Brauer, en collaboration avec Marianne Baudler, Handbuch der Präparativen Anorganischen Chemie, 3e éd. révisée, vol. 2, Ferdinand Enke, Stuttgart, 1978, p. 1057. (ISBN 3-432-87813-3)

