Récif d'éponge
Les « récifs d’éponge » sont des récifs marins biogéniques (c’est-à-dire construits par des êtres vivants) qui se sont lentement formés en profondeur, un peu à la manière des récifs coralliens. Ils sont construits à base de silice (et non de carbonate de calcium comme les coralliens), par des éponges du groupe des éponges marines à squelette de silice appelées « éponges de verre » (Hexactinellides) ; ces êtres filtreurs coloniaux comptent parmi les plus anciens animaux à corps dur de la planète.


D’immenses récifs d’éponges étaient autrefois communs (au Mésozoïque et Jurassique tardif)[1]. Les géologues, biologistes marins et écologues les pensaient disparues à la fin du Crétacé quand les dinosaures non-aviens se sont éteints[1]… jusqu’à ce qu’on en retrouve un exemplaire puis quelques autres dans les années 1980. Quelques communautés d’éponges ont en effet été (re)découvertes en 1987-1988[2] incluant des espèces généralement considérées comme « panchroniques » et d’un très grand intérêt pour les géosciences[1].
Plusieurs récifs d’éponges, déjà pour moitié dégradés par les activités humaines, ont été plus récemment retrouvés dans les eaux du Canada.
Les quelques récifs d'éponges aujourd'hui connus dans le monde ont un âge estimé à 9000 à 10 000 ans (fin de la dernière glaciation). De telles structures sont considérées comme très rares et a priori (à ce jour, au vu des connaissances disponibles) uniquement présentes sur le plateau continental de l'Ouest du Canada. La première observation humaine directe d'un tel récif date de 1999[1].
Description et structure d'un récif d'éponges
Chaque éponge siliceuse vivante à la surface de ce type de récif peut mesurer plus de 1,5 m de haut (alors qu'ailleurs elles mesurent rarement plus de quelques centimètres ou dizaines de centimètres).
Les récifs sont composés de monticules plus élevés dits « biohermes » (atteignant souvent plus de 10 m d'épaisseur et jusqu'à 21 m selon les données disponibles en 2005)[3], et de couches dites « biostromes » (de 2 à 10 m d'épaisseur)[3]. Un récif peut s'étendre sur plusieurs kilomètres de largeur[3].
Dans tous les cas connus, ces récifs se développent longitudinalement parallèlement aux creux et fosses glaciaires. Cette morphologie semble résulter du substrat en place, des températures de l'eau et des courants profonds (qui dépendent eux-mêmes de courants océaniques globaux et de la géomorphologie régionale du fond marin [6] "
Les éponges de l'ordre Hexactinosa y grandissent généralement sur les squelettes rigides laissés par celles qui ont vécu avant elles. La résille de spicules de silice sert de substrat aux larves d'éponges qui peuvent s'y installer puis se développer, et de nouvelles éponges poussent sur le cadre des générations passées. La croissance des récifs d'éponge présente de ce point de vue une certaine analogie avec celle des récifs coralliens : le récif croit sur le squelette des organismes de la génération précédente.
Les fonds marins sont exposés à une neige perpétuelle de particules venues de la surface (et des fleuves) et de déjections et cadavres provenant des organismes qui vivent et meurent dans la colonne d'eau. Ces particules servent de substrat et d'aliments pour les bactéries du fond, mais les éponges se débarrassent des bactéries qui chercheraient à les coloniser et des sédiments qui se déposent sur elles. Une partie de ces sédiments fins (dont limons et particules d'argiles) est cependant capturée par l'échafaudage des récifs bio-construits par les éponges[4]. Ils s'y tassent peu à peu en formant une matrice qui formera la base des biohermes d'éponge et de futures roches partiellement sédimentaires à teneur élevée en silice et carbone organique[4]. Cette matrice de sédiments est molle et pulvérulente près de la surface ainsi qu'à la surface des éponges mortes, mais de plus en plus ferme en profondeur (dès un mètre de profondeur sous la surface du récif)[4];
Enjeux écosystémiques
Des recherches plus poussées sont nécessaires pour mieux évaluer l'importance écologique globale de ces récifs[5] mais on sait déjà qu'ils sont dominés par des assemblages de grandes éponges qui - comme les coraux mais d'une manière différente - sont des organismes filtreurs ; ils contribuent donc à épurer l'eau. Ces organismes bioconstructeurs fournissent des habitats et abris supplémentaires pour les poissons et divers invertébrés à une profondeur où les coraux ne pourraient le faire. Les observations faites par ROV et submersible habité montrent que la faune des récifs d'éponge est spécifique (elle diffère des zones environnantes)[2]. Les récifs favorisent la présence de vers annélides, de bryozoaires, des grands crustacés des familles de Lithodidae et de Majoidea, ainsi que de petits crustacés (crevettes, krills), de diverses espèces d'échinodermes (oursins et étoiles de mer nettement plus abondantes dans les zones du récif où les éponges étaient blessées ou mourantes, ce qui laisse penser qu'ils pourraient être utilisés comme bioindicateurs de la santé du récif d'éponges, et des éponges elles-mêmes)[4].
Certains poissons, dont plusieurs espèces de sébastes semblent profiter du récif ou en dépendre (Certains sébastes vivent dans les espaces disponibles entre les éponges[4] ; et des femelles gravides ainsi que des juvéniles y ont été observés suggérant qu'ils utilisent le récif d'éponge comme zone de frai et de nurserie[3].
Les foraminifères abondent autour des récifs, mais les diatomées sont rares.
Selon Krautter (2001) les communautés vivantes (animales et bactériennes) associées aux derniers récifs d'éponge contemporains ont probablement peu changé depuis le Jurassique[4].
Enjeux biogéochimiques ?
À la différence des récifs coralliens et constitués de stromatolites, les récifs d'éponges ne jouent qu'un rôle a priori très mineur pour le cycle du carbone, mais ils ont joué dans le passé un rôle majeur dans le cycle de la silice.
Leur rôle actuel dans le cycle biogéochimique est encore à préciser (il semble plus local).
La silice n'est pas rare dans l'océan et un calcul du budget simple d'absorption de silice à l'échelle d'un récif d'éponge de 425 km2 montre que ce récif n'aurait qu'un impact léger le « budget-silice » de toute la région[3].
Enjeux scientifiques, biotechnologiques et économiques
Les récifs d'éponges sont une fenêtre ouverte sur la vie océanique d'époques reculées. Mais ils intéressent aussi les experts en biomimétique, biominéralisation, chimie bioinorganique et nanotechnologies pour la capacité qu'ont ces éponges à capter, condenser et mettre en forme la silice en solution pour en faire des biominéraux hybrides, grâce notamment à un gène qui contrôle la production d'enzymes et de protéines spéciales[6] telles que Cathépsines[7], glassines[8] et Silicatéines)[9] - [10]). Les diatomées savent aussi manipuler la silice, mais à des échelles bien plus petites. Comprendre comment les éponges de verre biominéralisent la silice permettrait peut-être d'imprimer des fibres optiques ou des matériaux isolants et translucides dans de l'eau ou dans un autre matériau, sans polluer et presque sans consommer d'énergie[11].
Anatomie et biologie des éponges hexactinellidiennes et de leurs récifs
Ces récifs sont en quelque sorte des superorganismes principalement constitués d'hexactinellides (dites éponges " de verre ") qui sont caractérisées par :
- un squelette rigide, constitué d’un assemblage particulier de minuscules spicules de silice.
Les éponges dites hexagonophores ont des spicules dénommées « hexactines » qui ont six rayons perpendiculaires. Les espèces sont classées selon la taille et forme des spicules et selon la manière dont les spicules se verrouillent entre elles. Chez les « éponges de verre » les spicules fusionnent très solidement entre elles, produisant un squelette qui persiste après la mort de l'éponge. Les « éponges de verre » produisent un écho sonar particulier (qui mime celui d'un réflecteur gazeux) qui permet de facilement les différencier des tapis d'autres Démosponges, et qui a aidé à la détection de leurs récifs. - Contrairement à d'autres porifères, les hexactinellides ne peuvent pas se contracter.
- des tissus composés presque entièrement de syncytia[5] Dans un syncytium, il existe de nombreux noyaux éparpillés dans un cytoplasme continu (ces noyaux ne sont pas associés à une seule cellule). ceci confère à l’éponge un système de conduction électrique particulier, qui lui permet de répondre rapidement à certaines perturbations (agression physique ou présence excessive de sédiments dans l'eau ; qui provoque un arrêt de l'alimentation, qui reprendra après 20-30 minutes, mais s'arrêtera de nouveau si l'irritation se reproduit[5]).
Biomasse et répartition des récifs d’éponge dans le monde
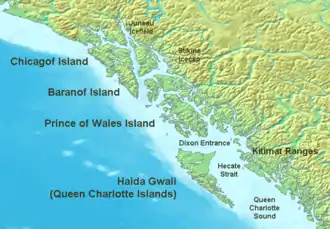
Des "éponges de verre" ont été trouvées individuellement ou en petits groupes de manière éparse dans le monde entier, jamais près de la surface, rarement en eaux moyennement profonde et presque toujours en eaux profondes ou très profondes (grands fonds marins). Mais elles ne semblent encore forment de véritables récifs qu'à une profondeur intermédiaire, et sur le plateau continental de l'Ouest canadien[5] - [3] - [12].
De même pour les communautés d'éponges de la famille des Rosselidae, capables de former des « tapis d'éponges » : elles sont constituées d'espèces largement distribuées dans les océans, principalement présentes dans les canyons dans l'Atlantique Nord, dans l'Arctique canadien et sur la plateforme continentale Antarctique[3], mais ces deux groupes d'espèces ne se réunissent pour encore former de véritables récifs que dans un petit nombre de lieux :
- quatre récifs hexacérineux ont été découverts dans les années 1980 dans le « bassin de la Reine-Charlotte » (explorés en 1987-1988). Ils sont situés à 70-80 km de la côte et à 165-240 m de profondeur[4]. Ils s’étendent sur plus de 700 km2 du plancher océanique[3] ;
- trois autres récifs ont été signalés dans le bassin de la Géorgie (GB) en 2005[12] ;
- des communautés denses d'espèces de Demospongiae siliceuses ont aussi été découvertes plus au nord (sous la banquise ; au large de L'île Axel Heiberg, une très grande île de l'océan Arctique, située dans la région du Qikiqtaaluk dans le Nunavut au Canada)[13], abritant des bryozoaire et de nombreux autres invertébrés. L'espèce dominante est dans ce cas une éponge siliceuse sphéroïde de 1,2 à 30 cm de diamètre appartenant au genre Geodia (classe : Demospongea, ordre : Chloristida, famille Geodiidae).
Au-dessus de 130 m de fond des communautés d'éponges siliceuses de grande taille avaient construit des récifs atteignant une dizaine de mètres de hauteur[13], et en dessous (de 130 à 150 m) les chercheurs ont découvert quelques éponges, mais aussi des tapis de spicules sur le fond. Plus bas encore (entre 150 et 300m) il n'y avait presque plus d'éponges vivantes, et des analyses au radiocarbone des tapis de spicules ont montré « que durant les 500-2000 dernières années il y a eu extinction d'anciennes communautés d'éponges. Cette zonation peut être le reflet d'une augmentation de 40 à 60m de l'épaisseur de la tranche d'eau, relativement au niveau de mer, au cours des 1000 dernières années. Alternativement, il se pourrait que cette zonation représente une remontée de 20 à 30 m de la couche d'eau chaude de l'Atlantique au cours des 500 -1000 dernières années, signalant peut-être un réchauffement climatique global »[13] concluaient en 1991 les auteurs de la découverte.
La biomasse sèche d'une grosse éponge siliceuse présente un poids très modeste, mais les biohermes récifaux qu'elles forment atteignent couramment près d'une vingtaine de mètres de hauteur, et elles sont couvertes sur une surface estimée aujourd'hui à environ 700 km2 d'une couche vivante d'éponges hexactinellidiennes de 1,5 m de hauteur environ[1]. Elles ont dans le passé formé des couches géologiques dites « biostromes »[1].
Habitats
Les hexacinellides sont exclusivement marines. Très anciennes, bien adaptées aux fortes pressions et n'ayant pas besoin de lumière, elles ont colonisé les grands fonds de l’océan mondial sur tout le globe (souvent à plus de 1000 m) [3].
Dans le détroit d'Hecate et dans le bassin de la Reine-Charlotte, des « downwellings » (masses d'eau descendant du haut vers le bas) sont fréquentes, en hiver notamment. Mais des « upwellings » se produisent aussi occasionnellement en été ; ces derniers remontent des eaux froides et enrichies en nutriments à partir des grands fonds, jouant probablement un rôle important dans la nutrition des récifs d'éponges [3].
Croissance du récif
Comme beaucoup d’organismes des grands fonds les éponges siliceuses croissent lentement (bien que des croissances de 7 cm/an aient été observées) et elles semblent vivre longtemps (ex : 220 ans estimés pour certains sujets)[4]. Quand une éponge siliceuse meurt, sa chair se décompose rapidement, mais son squelette reste en place. Les propagules d'éponges de la même espèce peuvent alors s'y accrocher et le recoloniser. Peu à peu des sédiments sont piégés dans les entrelacs d'éponge et le récif s'épaissit et/ou s'élargit.
Alimentation
Comme tous les porifères, les hexactinellides sont des organismes filtreurs qui consomment des sels dissous directement prélevés dans le milieu, et (moindrement) des microparticules[3].
Ces éponges sécrètent des anti-microbiens puissants et on ne connait pas encore de prédateurs ou d’organismes s’attaquant aux récifs d’éponges sains (mis à part l’être humain)[4]. [5] C'est peut-être parce que les éponges possèdent très peu de tissu organique, et que les spicules qui composent leur squelette sont de minuscules dards (90 % du poids corporel de l'éponge)[3].
Reproduction
On ne sait pas les élever hors de leur milieu naturel, et on ignore presque tout de leur reproduction.
Espèces composant les communautés récifales d'éponges
Pour les récifs connus, les éponges qui construisent directement des biorécifs appartiennent toutes à l'ordre des Hexactinosa[14]. Elles incluent les trois espèces suivantes (Chonelasma) :
D'autres espèces d'éponge, également abondantes sur les récifs d’éponge, appartiennent à l’ordre Lyssactinosa et à la famille des Rosselidae ; elles incluent
- Rhabdocalyptus dawsoni[4] ;
- Acanthascus platei[4] ;
- Acanthascus cactus[4] ;
- Staurocalyptus dowlingi[4].
Les éponges Rosselidae s’installent sur les récifs d’éponge, mais sans directement participer à leur construction, car leur squelette siliceux "tissé" ou très "lâche" ne persiste pas après la mort de l'éponge ; Elles peuvent cependant former des « tapis d’éponges » associés au récif et après leur mort, leurs spicules sont intégrés dans le sédiment piégé par le récif[5]
Un grand nombre d'autres espèces (poissons, crustacés, invertébrés, bactéries...) vivent aussi dans le récif.
Histoire géologique

Les éponges hexactinellidiennes sont des fossiles vivants dont les premières traces connues (fossiles) sont datées du Protérozoïque tardif. Les premiers hexactinosiens ont été retrouvés dans les couches géologiques du Dévonien tardif[4].
Les véritables récifs d'éponges hexactinellidiennes ont d'abord été identifiés dans le Trias moyen (245-208 millions d'années avant nos jours) mais ils ont atteint leur plein épanouissement au Jurassique tardif (il y a 208-146 millions d'années) avec alors un récif s'étendant de manière discontinue sur 7 000 km de long des bassins nordiques de la mer de Tethys à l'Atlantique Nord[4]. Cette chaîne de gigantesques récifs d'éponge semble même avoir été la plus grande biostructure connue ayant jamais existé sur Terre[4].
Ces récifs d'éponge ont ensuite régressé durant tout le Crétacé alors que les récifs coralliens et rudistes devenaient de plus en plus importants [4].
Pourquoi ces récifs sont-ils si rares
Une hypothèse (encore à confirmer) est que la diffusion dans le monde des diatomées qui sont des microalgues à squelette siliceux aurait pu avoir porté préjudice aux éponges hexactinellidiennes au travers d'une concurrence pour la silice en tant que ressource vitale pour chacun de ces organismes [3].
Quelques communautés récifales d’éponges ont néanmoins survécu dans le nord-Est du Pacifique, mais elles semblent nécessiter des conditions de croissances particulières, encore mal comprises. Ces conditions ne semblent plus aujourd’hui que rarement réunies :
- Géomorphologie : Les récifs d'éponges ne sont présents que dans certaines fosses d’abrasion glaciaire laissées par les dernières glaciations dans le plateau continental, à faible pente[3].
- Substrat : le fond doit être dur, composé de gravier grossier et de gros rochers ; ces éponges ne survivent pas en colonies sur le sable ni sur un fond vaseux ou composé de sédiments fins[4].
- Courantologie : il semble que dans les zones étudiées des courants de fonds de moins de~ 25 cm s-1 soient nécessaires pour leur apporter leur nourriture tout en éliminant du récif (et des fonds marins environnants) les sédiments qui sans cela s'y accumuleraient. upwellings et endoupwellings pourraient aussi jouer un rôle (encore à démontrer)
- Sédimentologie : selon les données disponibles, ces récifs ne se survivent que dans des zones où le taux de sédimentation est faible, et où le taux de silice en solution dans l’eau est élevé (43-75 μM). Whitney estime que la vitesse du courant doit être comprise entre 0,15 et 0,30 m/s[3].
- Oxygène : les éponges sont des animaux. Elles ont besoin d'un minimum d'oxygène et certains fonds marins riches en matière organique peuvent être anoxiques et source de CO2, de méthane voire d'hydrogène sulfuré toxique. Dans leur milieu le taux d'oxygène dissous est bas (64-152 μM), mais des températures plutôt froides (5,5-7,3 °C)[3] au niveau du récif (alors qu’elles sont en surface de 6 °C en avril et 14 °C en août[4]) favorisent une meilleure dissolution de l'oxygène dans l'eau.
Menaces
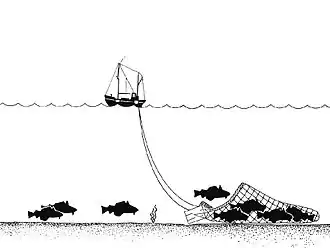
Le squelette siliceux des éponges récifales est fragile. Ces animaux se cassent ou sont facilement écrasés par les chaluts et dragues. [2] Presque dès leur découverte les scientifiques ont constaté que les trois récifs du bassin de la Reine Charlotte étaient déjà dégradés par la pêche industrielle (au chalut et à la drague).
Les scientifiques découvrent des pistes parallèles laissées sur le font à des intervalles de 70-100 m, pistes qui peuvent s'étendre sur plusieurs kilomètres, ceci à des profondeurs de 210-220 m[5]. Sur ces « traits de chaluts » et à proximité les éponges sont brisées, mortes ou agonisantes ou ont complètement disparu. Les engins trainants remettent aussi le sédiment en suspension, qui peut gêner la cicatrisation du récif[5].
Moins dangereux que le chalut, la pêche au filet et la pêche à la ligne sur le fond, ainsi que le piégeage de crustacés (nasses/casiers) endommagent néanmoins aussi les récifs. Toute ancre, engin posé ou tracté sur le fond ou susceptible de s'accrocher aux éponges peut briser des éponges sur plusieurs mètres. Des « souches » d'éponges cassées, et des éponges dont il manquait des morceaux ont été trouvées dans des secteurs où la pêche à la ligne et à la nasse/casier ont lieu[5].
La rupture des éponges de récif près de leur base peut avoir des conséquences désastreuses pour le recrutement de nouvelles éponges, car c'est sur le squelette des éponges mortes que les larves d'éponges construisent leur propre squelette siliceux (qui élèvera le précédent au-dessus du substrat et des matériaux qui sédimentent dans le récif)[4].
L'industrie pétrogazière peut aussi être une source de menace pour ces espèces[5] - [15], directement via les travaux d'exploration et d'exploitation faits en mer, de plus en plus loin des côtes et à des profondeurs de plus en plus importantes, et indirectement via les polluants perdus accidentellement ou non par les plateformes de forage (fuites, accidents...) et via la contribution des énergies fossiles au dérèglement climatique.
En effet les espèces composant ces récifs semblent toutes nécessiter de basses températures. Le réchauffement de la planète et plus encore celui des eaux profondes (et peut-être des modifications de salinité liées à la fonte des glaces ?) pourraient donc éventuellement aussi être une cause de déclin et de mort de récifs d'éponges siliceuses[13].
Protection
Un début de protection de ces écosystèmes remarquables et uniques se met en place.
Il passe notamment par une meilleure connaissance de la position de ces récifs[16] et par la création de zones marines protégées dédiées aux récifs d'éponges et à leur périphérie. Le premier objectif est de supprimer les dégâts induit par la pêche industrielle[5].
Une première aire marine protégée a été la « Zone de protection marine des récifs d'éponges siliceuses du détroit d'Hécate et du bassin de la Reine-Charlotte »
Notes et références
- Conway K.W, Krautter M, Barrie J.V & Neuweiler M (2001). Hexactinellid sponge reefs on the Canadian continental shelf: A unique" living fossil". Geoscience Canada, 28(2)
- Department of Fisheries and Oceans (2000), Hexactinellid sponge reefs on the British Columbia continental shelf : geological and biological structure. DFO Pacific Region Habitat Status Report 2000/02.
- Whitney F, Conway K, Thomson R, Barrie V, Krautter M & Mungov G. (2005). Oceanographic habitat of sponge reefs on the western Canadian continental shelf. Cont Shelf Res, 25: 211-226|résumé.
- Krautter M, Conway K, Barrie JV, and Neuweiler M. (2001), Discovery of a "living dinosaur": globally unique modern hexactinellid sponge reefs off British Columbia, Canada. Facies, 44: 265-282
- Jamieson GS, and Chew L. (2002). Hexactinellid sponge reefs: areas of interest as marine protected areas in the north and central coast areas. Can Sci Adv Sec Res Doc 12.
- Otzen D (2012). The role of proteins in biosilicification. Scientifica, 2012.
- Riesgo, A., Maldonado, M., López-Legentil, S., & Giribet, G. (2015). A Proposal for the Evolution of Cathepsin and Silicatein in Sponges. Journal of molecular evolution, 80(5-6), 278-291.
- Shimizu, K., Amano, T., Bari, M. R., Weaver, J. C., Arima, J., & Mori, N. (2015). Glassin, a histidine-rich protein from the siliceous skeletal system of the marine sponge Euplectella, directs silica polycondensation. Proceedings of the National Academy of Sciences, 112(37), 11449-11454.
- Müller, W. E., Schröder, H. C., Burghard, Z., Pisignano, D., & Wang, X. (2013). Silicateins—a novel paradigm in bioinorganic chemistry : enzymatic synthesis of inorganic polymeric silica. Chemistry-A European Journal, 19(19), 5790-5804|résumé.
- Shkryl, Y. N., Bulgakov, V. P., Veremeichik, G. N., Kovalchuk, S. N., Kozhemyako, V. B., Kamenev, D. G., ... & Kulchin, Y. N. (2016). Bioinspired enzymatic synthesis of silica nanocrystals provided by recombinant silicatein from the marine sponge Latrunculia oparinae. Bioprocess and biosystems engineering, 39(1), 53-58|résumé.
- Müller, W. E., Link, T., Schröder, H. C., Korzhev, M., Neufurth, M., Brandt, D., & Wang, X. (2014). Dissection of the structure-forming activity from the structure-guiding activity of silicatein: a biomimetic molecular approach to print optical fibers. Journal of Materials Chemistry B, 2(33), 5368-5377.
- Conway K, Barrie J, and Krautter M. (2005). Geomorphology of unique reefs on the western Canadian shelf : sponge reefs mapped by multibeam bathymetry. Geo-Mar Lett, 2005: 205-213.
- Eluik L (1991). Siliceous sponge communities, biological zonation, and recent sea-level change on the Arctic margin : Ice Island results: Discussion. Can J Earth Sci, 28: 459-462.
- Commission géologique du Canada - Les récifs spongieux sur le plateau continental ; éponges constructrices de récifs | archives (avec 3 illustrations), consultées le 10 sept 2017
- Canadian Parks and Wilderness Society (2004), Protecting the glass sponge reefs from offshore oil and gas|URL:« http://cpawsbc.org/pdfs/glass_sponge_reefs.pdf »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?). | consulté 28 mars 2008.
- http://biblio.uqar.ca/archives/30135712.pdf
Voir aussi
Liens externes
- The Sponge Reef Project. http://www.porifera.org/a/ciopen.html.
- Natural Resources Canada. Sponge Reefs on the continental shelf. http://gsc.nrcan.gc.ca/marine/sponge/index_e.php.
- Austin W.C. (2003) Sponge gardens: A hidden treasure in British Columbia. http://www.mareco.org/khoyatan/spongegardens/home/.
- University of California Museum of Paleontology. Hexactinellida. http://www.ucmp.berkeley.edu/porifera/hexactinellida.html .
- Site officiel
Bibliographie
- Cook, S.E. (2005). Ecology of the Hexactin ellid Sponge Reefs on the Western Canadian continental shelf. M.Sc. Thesis, Univ of Victoria, Victoria, BC: 136 p.
- Conway, K.W. (1999). Hexactinellid Sponge R eefs on the British Columbia continental shelf: geological and biologica l structure with a perspectiv e on their role in the shelf ecosystem. Can. Stock Assess. Sec. Res. Doc. 99/192: 20 p.
- Conway, K.W., J.V. Barrie, W.C. Austin a nd J.L. Luternauer. (1991). Holocene sponge bioherms on the western Cana dian continental shelf. Continental Shelf Research 11(8-10): 771-790.
- Conway, K.W., J.V. Barrie and Krautter, M. (2004). Modern siliceous sponge reefs in a turbid silicclastic setting: Fraser Rive r delta, British Columbia, Canada. Neues Jahrbuch für Geologie und Paläontologie, Monatshefte, 2004/6: 335-350.
- Conway, K.W., J.V. Barrie, W.C. Austin, P. R. Ruff and M. Krautter. (2005). Deep-water sponge and coral habitats in the coastal waters of British Columbia, Canada : multibeam and ROV survey results. Abstract: Third International Symposium on Deep-sea Corals, Miami, Nov 28-Dec 2, 2005: p. 32.
- Conway, K.W., J.V. Barrie and M. Krautter. (2005). Geomorphology of unique reefs on the western Canadian shelf: sponge reefs mapped by multibeam bathymetry. Geo- Mar Lett. 25: 205-213.
- Conway, K.W., M. Krautter, J.V. Barrie and M. Neuweiler (2001) Hexactinellid sponge reefs on the Canadian continental shelve: A unique “Living Fossil”. Geoscience Canada 28(2): 71-78
- Conway, K.W., Krautter, M., Barrie., J.V., Whitney, F., Thomson, R.E., Reiswig, H., Lehnert, H., Mungov, G., and Bertram, M. (2005) Sponge reefs in the Queen Charlotte Basin, Canada: controls on dist ribution, growth and development. pp. 605-621. In: Freiwald, A. & Roberts J.M. (e ds): Cold-water Corals and Ecosystems, Springer (Berlin Heidelberg).
- Eluik L (1991). Siliceous sponge communities, biological zonation, and recent sea-level change on the Arctic margin : Ice Island results: Discussion | Can J Earth Sci, 28: 459-462|PDF, 15p.
- DFO (2000). Report of the PSARC Habitat S ubcommittee meeting December 7-8, 1999. DFO Can. Sci. Advis. Sec. Proceed. Ser. 99/35. 24p. http://www.dfo-mpo.gc.ca/csas /Csas/Proceedings/1999/p99_35.pdf
- DFO (2002). Proceedings of the PSARC Habitat Subcommittee Meeting, November 5-7, 2002. DFO Can. Sci. Advis. Sec. Proceed. Ser. 2002/029: 33 p. http://www.dfo-mpo.gc.ca/csas/C sas/proceedings/2002/PRO2002_029e.pdf 13
- DFO (2004). Identification of Ecologically a nd Biologically Significant Areas. DFO Can. Sci. Advis. Sec. Ecosystem Status Rep. 2004/006: 15 pp. http://www.dfo-mpo.gc.ca/csas/C sas/status/2004/ESR2004_006_e.pdf
- DFO, (2006). Impacts of Trawl Gears and Scallop Dredges on Benthic Habitats, Populations and Communities. DFO Can. Sci. Advis. Sec. Sci. Advis. Rep. 2006/025: 13 pp. http://www.dfo-mpo.gc.ca/csas/C sas/status/2006/SAR-AS2006_025_E.pdf
- DFO, (2006). Identification of Ecologically and Biologically Significant Species and Community Properties. DFO Can. Sci. Advis. Sec. Sci. Advis. Rep. 2006/028: 45 pp. | http://www.dfo-mpo.gc.ca/csas/Csa s/status/2006/SAR-AS2006_028_E.pdf
- Jamieson, G.S. and L. Chew. (2002). Hexactinel lid Sponge Reefs: Areas of Interest as Marine Protected Areas in the North and Central Coast Areas. DFO Can. Sci. Advis. Sec. Res. Doc. 2002/122: 78 pp.
- Krautter, N., K.W. Conway and J.V. Barrie. (2006). Recent hexactinosidan sponge reefs (silicate mounds) off British Columbia, Canada: frame-building processes. J. Paleont. 80: 38-48.
- Sinclair, A.F., K.W. Conway and W.R. Crawford. (2005). Associations between bathymetric, geologic and oceanographic feat ures and the distribution of the British Columbian bottom trawl fishery. ICES CM 2005/L:25