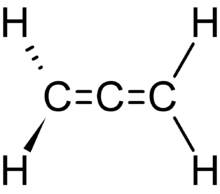
Propadiène
Le propadiène ou allène est le premier représentant des allènes, à savoir les hydrocarbures présentant deux doubles liaisons C=C directement enchaînées. Sa formule brute est : C3H4.
| Propadiène | |
   |
|
| Identification | |
|---|---|
| Nom UICPA | Propan-1,2-diène |
| Synonymes |
allène |
| No CAS | |
| No ECHA | 100.006.670 |
| No CE | 207-335-3 |
| PubChem | 10037 |
| ChEBI | 37601 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C3H4 [Isomères] |
| Masse molaire[1] | 40,063 9 ± 0,002 7 g/mol C 89,94 %, H 10,06 %, |
| Propriétés physiques | |
| T° fusion | −136,3 °C |
| T° ébullition | −34,5 °C [2] |
| Solubilité | insoluble dans l'eau |
| Limites d’explosivité dans l’air | 1,7 % -17 % |
| Pression de vapeur saturante | 7,096 bar (20 °C) 9,1 bar (30 °C) 14,8 bar(50 °C) |
| Viscosité dynamique | 7,72 × 10−6 Pa s (1,013 bar et 0 °C, gaz) |
| Point critique | 120,85 °C [2], 54,7 bar [3] |
| Thermochimie | |
| Cp | |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 9,692 ± 0,004 eV (gaz)[5] |
| Précautions | |
| Directive 67/548/EEC | |
 F+ |
|
| Transport | |
| Unités du SI et CNTP, sauf indication contraire. | |
Synthèse et tautomérie
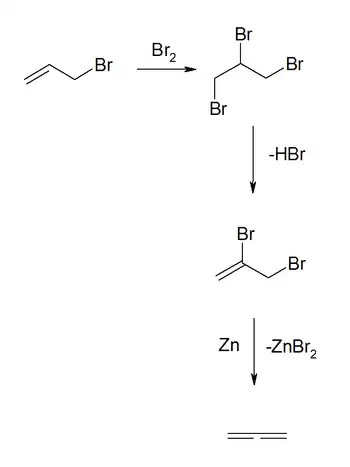
La préparation du propadiène démarre à partir de bromure d'allyle. Ce dernier est converti avec du brome en 1,2,3-tribromopropane (en) qui subit ensuite une déshydrohalogénation en 2,3-dibromopropène. Finalement, une réduction à l'aide de poudre de zinc donne le propadiène[6]:
Le propadiène est en fait en équilibre tautomérique avec le propyne, le mélange étant appelé MAPD pour MéthylAcétylène (nom trivial du propyne)-PropaDiène :
- H3CC≡CH ⇌ H2C=C=CH2 avec Keq = 0,22 (270 °C)/ 0,1 (5 °C)
Le MAPD apparaît comme un produit secondaire, souvent indésirable, dans le craquage de propane en propène, un composé de première importance dans l'industrie chimique. Ce MAPD interfère dans la polymérisation catalytique du propène[7].
Caractéristiques
- Phase liquide :
- Point d'ébullition (1,013 bar) : −34,4 °C
- Masse volumique de la phase liquide (1,013 bar au point d'ébullition) : 657,5 kg·m-3
- Équivalent gaz/liquide (1,013 bar et 15 °C) : 386 vol/vol
- Chaleur latente de vaporisation (1,013 bar au point d'ébullition) : 464,73 kJ/kg
- Phase gazeuse :
- Masse volumique du gaz (1,013 bar au point d'ébullition) : 2,12 kg·m-3
- Masse volumique de la phase gazeuse (1,013 bar et 15 °C) : 1,69 kg·m-3
- Facteur de compressibilité (Z) (1,013 bar et 15 °C) : 0,9839
- Masse volumique (air = 1) (1,013 bar et 21 °C) : 1,41
- Chaleur spécifique à pression constante (Cp) (1,013 bar et 25 °C) : 0,073 kJ/(mole.K)
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Iwona Owczarek et Krystyna Blazej, « Recommended Critical Temperatures. Part I. Aliphatic Hydrocarbons », J. Phys. Chem. Ref. Data, vol. 32, no 4, , p. 1411 (DOI 10.1063/1.1556431)
- « Properties of Various Gases », sur flexwareinc.com (consulté le )
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 1, Huston, Texas, Gulf Pub. Co., , 396 p. (ISBN 0-88415-857-8)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- Hauptmann/Graefe/Remane, "Lehrbuch der Organischen Chemie", Deutscher Verlag der Grundstoffindustrie, Leipzig, 1980, p. 230.
- Klaus Buckl, Andreas Meiswinkel, Propyne,Ullmann's Encyclopedia of Industrial Chemistry, 2008, Wiley-VCH, Weinheim. DOI 10.1002/14356007.m22_m01.