Facteur de compressibilité
En physique, et plus particulièrement en thermodynamique, le facteur de compressibilité désigne le rapport du volume molaire d'un mélange ou d'un corps pur réel, liquide ou gazeux, au volume molaire du gaz parfait correspondant aux mêmes pression, température et composition.
| Unités SI | Sans dimension |
|---|---|
| Nature | Grandeur scalaire intensive |
| Symbole usuel | |
| Lien à d'autres grandeurs |
Pour un gaz parfait, le facteur de compressibilité vaut 1, quelles que soient la nature du gaz et les conditions de pression, température, composition. Pour un fluide réel, le facteur de compressibilité est généralement compris entre 0,2 et 1,2, il dépend de la nature du fluide et des conditions opératoires.
Le facteur de compressibilité est une variable utilisée notamment dans les équations d'état telles que les équations d'état cubiques ou l'équation du viriel.
Définition
Le facteur de compressibilité, noté [1], est défini par :
| Facteur de compressibilité : |
avec :
- la pression du fluide réel ;
- la constante universelle des gaz parfaits ;
- la température du fluide réel ;
- le volume molaire du fluide réel, avec le volume et la quantité de matière totale (nombre de moles) du fluide réel.
Le facteur de compressibilité est une grandeur intensive adimensionnelle.
Le facteur de compressibilité est une fonction de la pression, du volume, de la température et de la composition. Ces diverses variables sont elles-mêmes liées par l'équation d'état du fluide : ou . Le facteur de compressibilité peut donc s'exprimer soit comme une fonction de la pression, de la température et de la composition , soit comme une fonction du volume, de la température et de la composition .
Selon la loi des gaz parfaits , avec le volume du gaz parfait aux mêmes pression, température et composition que le fluide réel. En posant le volume molaire du gaz parfait correspondant au fluide réel, on obtient une autre définition du facteur de compressibilité :
Pour un gaz parfait, on a donc quelles que soient la nature du gaz et les conditions de pression, température, composition.
Valeur pour un fluide réel
Diagramme d'Amagat
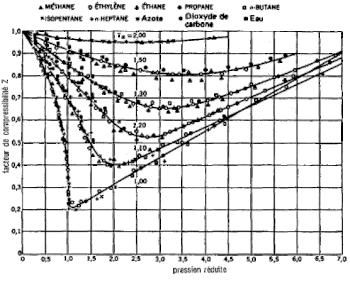
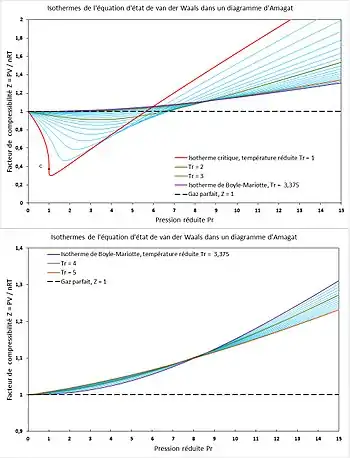
En violet : isotherme de Boyle-Mariotte ; en tirets noirs : droite des gaz parfaits ; en rouge : isotherme critique.
Pour un gaz parfait, le facteur de compressibilité vaut donc 1 quels que soient le gaz (corps pur ou mélange), la pression, la température et la composition. Si l'on trace dans un diagramme le facteur de compressibilité en fonction de la pression, on obtient une unique droite horizontale.
Pour un fluide réel, mélange ou corps pur, le facteur de compressibilité varie généralement entre 0,2 et 1,2 selon la nature du fluide et les conditions opératoires. Pour tracer dans un diagramme le facteur de compressibilité d'un fluide réel en fonction de la pression, on fixe la température et la composition pour obtenir une courbe isotherme. La variation de la température permet d'obtenir un faisceau de courbes isothermes. La figure 1 montre les isothermes obtenues expérimentalement pour diverses espèces chimiques et tracées dans un diagramme d'Amagat. La figure 2 montre dans un diagramme d'Amagat l'évolution isotherme du facteur de compressibilité d'un gaz suivant l'équation d'état de van der Waals, qui représente qualitativement[2] le comportement d'un gaz réel. On constate :
1- qu'à basse pression ou à haute température le facteur de compressibilité d'un fluide réel tend vers 1 : le comportement d'un fluide réel tend vers celui d'un gaz parfait ;
2- qu'à pression constante :
- aux basses pressions le facteur de compressibilité augmente avec la température ;
- aux hautes pressions le facteur de compressibilité diminue avec une augmentation de température ;
3- qu'à température constante :
- le facteur de compressibilité est décroissant aux basses pressions et croissant aux hautes pressions ;
- au-delà d'une certaine température le facteur de compressibilité est strictement croissant.
Au point critique, le facteur de compressibilité d'un gaz de van der Waals vaut quel que soit le corps, ce qui n'est pas réaliste. En règle générale, le facteur de compressibilité critique d'un corps réel vaut de 0,2 à 0,3[3]. On a par exemple respectivement pour l'hydrogène, l'éthane, l'ammoniac et l'eau : , , , .
Par définition, un gaz parfait est un gaz dans lequel des particules ponctuelles n'ont aucune interaction entre elles, si ce n'est des chocs élastiques. Autrement dit, dans un gaz parfait les particules n'ont aucune interaction à distance entre elles, contrairement aux fluides réels dans lesquels les particules interagissent à distance par les forces de van der Waals. Ainsi :
- si , le volume du fluide réel est inférieur à celui du gaz parfait correspondant, les forces d'attraction entre particules l'emportent sur les forces de répulsion ;
- si , le volume du fluide réel est supérieur à celui du gaz parfait correspondant, les forces de répulsion entre particules l'emportent sur les forces d'attraction ;
- si , le fluide se comporte comme un gaz parfait, les forces d'attraction et de répulsion entre particules s'annulent mutuellement.
Variation avec la pression, courbe de Boyle-Mariotte
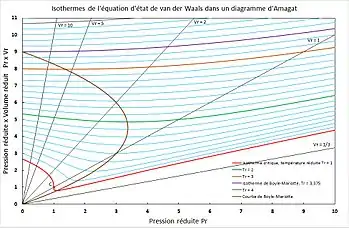
En marron : courbe de Boyle-Mariotte ; en violet : isotherme de Boyle-Mariotte ; en rouge : isotherme critique.
En dérivant le facteur de compressibilité par rapport à la pression, à température et quantité de matière constantes :
en introduisant le coefficient de compressibilité isotherme et en remarquant que pour un gaz parfait , on obtient :
Il s'agit de la pente des isothermes tracées dans le diagramme d'Amagat ci-dessus :
- lorsque cette pente est négative, le fluide est plus compressible que le gaz parfait correspondant : ; lors d'une compression les forces d'attraction entre molécules l'emportent sur les forces de répulsion et favorisent la compression ; ceci s'observe dans les gaz à basse pression ;
- inversement, lorsque cette pente est positive, le fluide est moins compressible que le gaz parfait correspondant : ; lors d'une compression les forces de répulsion entre molécules l'emportent sur les forces d'attraction et s'opposent à la compression ; ceci s'observe dans les gaz à haute pression et les liquides ;
- lorsque cette pente est nulle, le fluide a la même compressibilité que le gaz parfait correspondant : ; les forces d'attraction et de répulsion entre molécules se compensent lors de la compression ; dans le diagramme d'Amagat, les points correspondants sont les points auxquels la tangente à l'isotherme est une droite horizontale.
Pour un gaz parfait, selon la loi de Boyle-Mariotte, à température et quantité de matière constantes, , soit . Pour un fluide réel, le lieu des points des isothermes du diagramme d'Amagat de tangente horizontale (appelés points de Boyle-Mariotte) est appelé courbe de Boyle-Mariotte[4]. En effet, en tout point de tangente horizontale dans le diagramme d'Amagat, équivaut à .
Il existe une température, appelée température de Boyle-Mariotte, au-delà de laquelle les isothermes dans le diagramme d'Amagat n'ont plus de point de tangente horizontale et sont strictement croissantes. L'isotherme correspondante est appelée isotherme de Boyle-Mariotte. La courbe et l'isotherme de Boyle-Mariotte sont représentées sur la figure 3 pour un gaz de van der Waals.
Variation avec le volume
En utilisant la relation :
on obtient :
avec :
- le module d'élasticité isostatique du corps réel ;
- le module d'élasticité isostatique du gaz parfait.
Variation avec la température
En dérivant le facteur de compressibilité par rapport à la température, à pression et quantité de matière constantes :
en introduisant le coefficient de dilatation isobare et en remarquant que pour un gaz parfait , on obtient :
Ainsi :
- si , alors est croissant avec la température à pression constante, ce qui est le cas des gaz à basse pression ;
- si , alors est décroissant avec une température croissante à pression constante, ce qui est le cas des gaz à haute pression ;
- si , alors , équivalant à : en ces points le gaz suit la loi de Charles des gaz parfaits.
En dérivant le facteur de compressibilité par rapport à la température, à volume et quantité de matière constants :
en introduisant le coefficient de compression isochore et en remarquant que pour un gaz parfait , on obtient :
Ainsi :
- si , alors est croissant avec la température à volume constant ;
- si , alors est décroissant avec une température croissante à volume constant ;
- si , alors , équivalant à : en ces points le gaz suit la loi de Gay-Lussac des gaz parfaits.
Variation avec la composition
Soit un mélange de quantité de matière globale avec la quantité du constituant .
En dérivant le facteur de compressibilité par rapport à la quantité de matière globale à pression, température et fractions molaires des constituants constantes :
en introduisant le volume molaire et en remarquant que celui-ci ne dépend que de la pression, de la température et des fractions molaires, mais pas de la quantité de matière globale, soit et , on obtient :
Le facteur de compressibilité étant une grandeur intensive, il ne dépend pas de la quantité globale de matière du mélange.
En dérivant le facteur de compressibilité par rapport à la quantité de l'un des constituants du mélange, à pression, température et quantités des autres constituants constantes :
en introduisant le volume molaire partiel du constituant et le volume molaire du mélange réel, on obtient :
Ainsi :
- si , alors est croissant avec la quantité de croissante à pression et température constantes ;
- si , alors est décroissant avec la quantité de croissante à pression et température constantes ;
- si , alors : en ces points le gaz suit la loi d'Avogadro des gaz parfaits, pour lesquels .
Utilisation
Calcul de la masse volumique
Si l'on connait le facteur de compressibilité d'un corps (tabulé dans la littérature, voir par exemple la table donnée pour l'air plus bas), le volume molaire de ce corps (pur ou mélange, liquide ou gaz) se calcule selon :
Puisque la masse volumique se calcule selon :
avec la masse molaire du corps, on a :
où est la masse volumique du gaz parfait correspondant au corps réel (mêmes pression, température et composition).
- Unités
- Selon le Système international d'unités la pression est exprimée en Pa et la température en K. La masse molaire est généralement exprimée en g/mol (ou kg/kmol). La masse volumique calculée selon la formule ci-dessus est ainsi obtenue en g/m3 et doit être divisée par 1000 pour obtenir des kg/m3.
Équations d'état
Le facteur de compressibilité est souvent utilisé comme variable dans les équations d'état[5], par exemple dans les diverses formes d'équation du viriel :
ou dans les équations d'état cubiques, comme celles de van der Waals et de Redlich-Kwong :
ou encore dans les équations de Benedict–Webb–Rubin et de Lee-Kesler.
La loi des gaz parfaits revient à .
Coefficient de fugacité
Le coefficient de fugacité est défini par le rapport de la fugacité d'un corps , pur ou dans un mélange, à la pression partielle de ce corps dans le mélange, soit avec la fraction molaire du corps : . La pression partielle du corps est la fugacité de ce corps dans le mélange de gaz parfaits de mêmes pression, température et composition que le mélange réel. Pour un corps , pur ou dans un mélange, le coefficient de fugacité peut se calculer :
- avec une équation d'état dans laquelle le volume est exprimé explicitement en fonction de la pression , de la température et de la composition (nombre de moles de chacun des constituants du mélange), , comme l'une des formes de l'équation du viriel, selon :
- avec une équation d'état dans laquelle la pression est exprimée explicitement en fonction du volume , de la température et de la composition (nombre de moles de chacun des constituants du mélange), , telle que les équations d'état cubiques, selon :
avec :
- la dérivée partielle du facteur de compressibilité par rapport à la quantité du corps , à pression, température et quantités des corps autres que constants ;
- la dérivée partielle du facteur de compressibilité par rapport à la quantité du corps , à volume, température et quantités des corps autres que constants ;
- le nombre de moles du corps dans le mélange ;
- la quantité de matière totale (nombre de moles total) dans le mélange.
Pour un gaz parfait , d'où et .
Grandeurs résiduelles
Une grandeur résiduelle exprime l'écart entre une propriété extensive d'un fluide réel et la même propriété d'un gaz parfait dans les mêmes conditions de pression, température et composition que le fluide réel : . Pour un corps pur ou un mélange, les grandeurs résiduelles peuvent se calculer :
- avec une équation d'état dans laquelle le volume est exprimé explicitement en fonction de la pression , de la température et de la composition (nombre de moles de chacun des constituants du mélange), , comme l'une des formes de l'équation du viriel, selon :
- enthalpie libre molaire résiduelle :
- entropie molaire résiduelle :
- enthalpie molaire résiduelle :
- volume molaire résiduel :
- énergie interne molaire résiduelle :
- énergie libre molaire résiduelle :
- avec une équation d'état dans laquelle la pression est exprimée explicitement en fonction du volume , de la température et de la composition (nombre de moles de chacun des constituants du mélange), , telle que les équations d'état cubiques, selon :
- énergie libre molaire résiduelle :
- entropie molaire résiduelle :
- énergie interne molaire résiduelle :
- volume molaire résiduel :
- enthalpie molaire résiduelle :
- enthalpie libre molaire résiduelle :
avec :
- la dérivée partielle du facteur de compressibilité par rapport à la température du mélange, à pression et quantités de tous les constituants du mélange constantes ;
- la dérivée partielle du facteur de compressibilité par rapport à la température du mélange, à volume et quantités de tous les constituants du mélange constants.
Pour un gaz parfait , toutes les grandeurs résiduelles sont nulles.
Facteur de compressibilité de l'air
Le tableau suivant[6] donne le facteur de compressibilité de l'air en fonction de la pression et de la température.
| Pression absolue (bar) | ||||||||||||||
| Température (K) | 1 | 5 | 10 | 20 | 40 | 60 | 80 | 100 | 150 | 200 | 250 | 300 | 400 | 500 |
| 75 | 0,0052 | 0,0260 | 0,0519 | 0,1036 | 0,2063 | 0,3082 | 0,4094 | 0,5099 | 0,7581 | 1,0125 | ||||
| 80 | 0,0250 | 0,0499 | 0,0995 | 0,1981 | 0,2958 | 0,3927 | 0,4887 | 0,7258 | 0,9588 | 1,1931 | 1,4139 | |||
| 90 | 0,9764 | 0,0236 | 0,0453 | 0,0940 | 0,1866 | 0,2781 | 0,3686 | 0,4681 | 0,6779 | 0,8929 | 1,1098 | 1,3110 | 1,7161 | 2,1105 |
| 100 | 0,9797 | 0,8872 | 0,0453 | 0,0900 | 0,1782 | 0,2635 | 0,3498 | 0,4337 | 0,6386 | 0,8377 | 1,0395 | 1,2227 | 1,5937 | 1,9536 |
| 120 | 0,9880 | 0,9373 | 0,8860 | 0,6730 | 0,1778 | 0,2557 | 0,3371 | 0,4132 | 0,5964 | 0,7720 | 0,9530 | 1,1076 | 1,5091 | 1,7366 |
| 140 | 0,9927 | 0,9614 | 0,9205 | 0,8297 | 0,5856 | 0,3313 | 0,3737 | 0,4340 | 0,5909 | 0,7699 | 0,9114 | 1,0393 | 1,3202 | 1,5903 |
| 160 | 0,9951 | 0,9748 | 0,9489 | 0,8954 | 0,7803 | 0,6603 | 0,5696 | 0,5489 | 0,6340 | 0,7564 | 0,8840 | 1,0105 | 1,2585 | 1,4970 |
| 180 | 0,9967 | 0,9832 | 0,9660 | 0,9314 | 0,8625 | 0,7977 | 0,7432 | 0,7084 | 0,7180 | 0,7986 | 0,9000 | 1,0068 | 1,2232 | 1,4361 |
| 200 | 0,9978 | 0,9886 | 0,9767 | 0,9539 | 0,9100 | 0,8701 | 0,8374 | 0,8142 | 0,8061 | 0,8549 | 0,9311 | 1,0185 | 1,2054 | 1,3944 |
| 250 | 0,9992 | 0,9957 | 0,9911 | 0,9822 | 0,9671 | 0,9549 | 0,9463 | 0,9411 | 0,9450 | 0,9713 | 1,0152 | 1,0702 | 1,1990 | 1,3392 |
| 300 | 0,9999 | 0,9987 | 0,9974 | 0,9950 | 0,9917 | 0,9901 | 0,9903 | 0,9930 | 1,0074 | 1,0326 | 1,0669 | 1,1089 | 1,2073 | 1,3163 |
| 350 | 1,0000 | 1,0002 | 1,0004 | 1,0014 | 1,0038 | 1,0075 | 1,0121 | 1,0183 | 1,0377 | 1,0635 | 1,0947 | 1,1303 | 1,2116 | 1,3015 |
| 400 | 1,0002 | 1,0012 | 1,0025 | 1,0046 | 1,0100 | 1,0159 | 1,0229 | 1,0312 | 1,0533 | 1,0795 | 1,1087 | 1,1411 | 1,2117 | 1,2890 |
| 450 | 1,0003 | 1,0016 | 1,0034 | 1,0063 | 1,0133 | 1,0210 | 1,0287 | 1,0374 | 1,0614 | 1,0913 | 1,1183 | 1,1463 | 1,2090 | 1,2778 |
| 500 | 1,0003 | 1,0020 | 1,0034 | 1,0074 | 1,0151 | 1,0234 | 1,0323 | 1,0410 | 1,0650 | 1,0913 | 1,1183 | 1,1463 | 1,2051 | 1,2667 |
| 600 | 1,0004 | 1,0022 | 1,0039 | 1,0081 | 1,0164 | 1,0253 | 1,0340 | 1,0434 | 1,0678 | 1,0920 | 1,1172 | 1,1427 | 1,1947 | 1,2475 |
| 800 | 1,0004 | 1,0020 | 1,0038 | 1,0077 | 1,0157 | 1,0240 | 1,0321 | 1,0408 | 1,0621 | 1,0844 | 1,1061 | 1,1283 | 1,1720 | 1,2150 |
| 1000 | 1,0004 | 1,0018 | 1,0037 | 1,0068 | 1,0142 | 1,0215 | 1,0290 | 1,0365 | 1,0556 | 1,0744 | 1,0948 | 1,1131 | 1,1515 | 1,1889 |
Ces valeurs sont représentées sur les graphes suivants.
- Facteur de compressibilité de l'air en fonction de la pression.
 Isothermes entre 75 et 200 K
Isothermes entre 75 et 200 K Isothermes entre 250 et 1000 K
Isothermes entre 250 et 1000 K
Voir aussi
Notes et références
- Green Book (IUPAC), Quantities, Units and Symbols in Physical Chemistry, page 57, édition 2007.
- On note l'important décalage, par exemple, entre les isothermes critiques () de la figure 1, qui représente des valeurs expérimentales pour diverses espèces chimiques, et de la figure 2, qui représente les isothermes obtenues avec l'équation d'état de van der Waals : les valeurs expérimentales descendent jusqu'à environ , les valeurs calculées jusqu'à environ .
- Bernard Le Neindre, Constantes physiques des fluides purs : méthodes d’estimation, vol. K 692, éd. Techniques de l'Ingénieur, (lire en ligne), p. 16.
- Thermodynamique et énergétique, Volume 1, Lucien Borel, Daniel Favrat, Presses Polytechniques et Universitaires Romandes, 2005, (ISBN 2-88074-545-4), p. 264.
- Jacques Schwartzentruber, École nationale supérieure des mines d'Albi-Carmaux, « Quelques équations d'état usuelles », sur nte.mines-albi.fr, (consulté le ).
- Perry's chemical engineers' handbook, MCGraw-Hill, , 6e éd. (ISBN 0-07-049479-7) page 3-162.
Bibliographie
- Jean Vidal, Thermodynamique : application au génie chimique et à l'industrie pétrolière, Paris, Éditions Technip, coll. « Publications de l'Institut français du pétrole. », , 500 p. (ISBN 978-2-7108-0715-5, OCLC 300489419, lire en ligne).
- Christophe Coquelet et Dominique Richon, Propriétés thermodynamiques : Détermination pour les fluides purs, vol. BE 8030, Techniques de l'ingénieur, coll. « base documentaire Thermodynamique et énergétique, pack Physique énergétique, univers : Énergies », , p. 1-8.
- Jean-Pierre Corriou, Thermodynamique chimique : Diagrammes thermodynamiques, vol. J 1026, Techniques de l'ingénieur, coll. « base documentaire Thermodynamique et cinétique chimique, pack Opérations unitaires. Génie de la réaction chimique, univers Procédés chimie - bio - agro », , p. 1-30.
- Roland Solimando, Louis Schuffenecker et Jean-Noël Jaubert, Propriétés thermodynamiques du corps pur, Techniques de l'ingénieur (no AF 050), (lire en ligne), p. 8.























































































![{\displaystyle \ln \phi _{i}=\int _{0}^{P}\left[n\left({\partial Z \over \partial n_{i}}\right)_{P,T,n_{j\neq i}}+Z-1\right]{\mathrm {d} P \over P}}](https://img.franco.wiki/i/17c9e42d2f1e1a227a3a744afc084b1c939ec52d.svg)
![{\displaystyle \ln \phi _{i}=-\int _{+\infty }^{V}\left[n\left({\partial Z \over \partial n_{i}}\right)_{V,T,n_{j\neq i}}+Z-1\right]{\mathrm {d} V \over V}-\ln Z}](https://img.franco.wiki/i/0e179b023868c6200ab10b3d2d4b517672f8d75b.svg)











![{\displaystyle {{\bar {G}}^{\text{RES}} \over RT}=\int _{0}^{P}\left[Z-1\right]{\mathrm {d} P \over P}}](https://img.franco.wiki/i/9320f49e93a8585c744c562502953c8864ddb778.svg)
![{\displaystyle {{\bar {S}}^{\text{RES}} \over R}=-\int _{0}^{P}\left[T\left({\partial Z \over \partial T}\right)_{P,n}+Z-1\right]{\mathrm {d} P \over P}}](https://img.franco.wiki/i/af8da25abde2487fa83c4a365c8fc75a72769e79.svg)
![{\displaystyle {{\bar {H}}^{\text{RES}} \over RT}=-\int _{0}^{P}\left[T\left({\partial Z \over \partial T}\right)_{P,n}\right]{\mathrm {d} P \over P}}](https://img.franco.wiki/i/bb34f41c5fdc14579704a4a96502787329eb285a.svg)

![{\displaystyle {{\bar {U}}^{\text{RES}} \over RT}=-\int _{0}^{P}\left[T\left({\partial Z \over \partial T}\right)_{P,n}\right]{\mathrm {d} P \over P}-Z+1}](https://img.franco.wiki/i/17673a2b7a3a84e2a8b19a52455f8eef175ffae3.svg)
![{\displaystyle {{\bar {F}}^{\text{RES}} \over RT}=\int _{0}^{P}\left[Z-1\right]{\mathrm {d} P \over P}-Z+1}](https://img.franco.wiki/i/ae9064887cc1bffa69ecd51bd8919cef6ee409ef.svg)
![{\displaystyle {{\bar {F}}^{\text{RES}} \over RT}=-\int _{+\infty }^{V}\left[Z-1\right]\,{\mathrm {d} V \over V}-\ln Z}](https://img.franco.wiki/i/22b7e57a6d698eea42399127d1adb773965a9421.svg)
![{\displaystyle {{\bar {S}}^{\text{RES}} \over R}=\int _{+\infty }^{V}\left[T\left({\partial Z \over \partial T}\right)_{V,n}+Z-1\right]\,{\mathrm {d} V \over V}+\ln Z}](https://img.franco.wiki/i/d52ca1b11c70814b01daeac8512ea6eff580effc.svg)
![{\displaystyle {{\bar {U}}^{\text{RES}} \over RT}=\int _{+\infty }^{V}\left[T\left({\partial Z \over \partial T}\right)_{V,n}\right]{\mathrm {d} V \over V}}](https://img.franco.wiki/i/c646b659c52bd40b69ebf340e565a76c63d9d843.svg)
![{\displaystyle {{\bar {H}}^{\text{RES}} \over RT}=\int _{+\infty }^{V}\left[T\left({\partial Z \over \partial T}\right)_{V,n}\right]{\mathrm {d} V \over V}+Z-1}](https://img.franco.wiki/i/b72656e339706fa775ffb69218cfd66c1efc4b15.svg)
![{\displaystyle {{\bar {G}}^{\text{RES}} \over RT}=-\int _{+\infty }^{V}\left[Z-1\right]\,{\mathrm {d} V \over V}+Z-1-\ln Z}](https://img.franco.wiki/i/dd9c6b81b02d04f26e2710d0e6d04ac946329e5a.svg)




