Compressibilité
La compressibilité est une caractéristique d'un corps quantifiant sa variation relative de volume sous l'effet d'une pression appliquée. La compressibilité est une grandeur intensive homogène avec l'inverse d'une pression, elle s'exprime en Pa−1 (Pa étant le pascal).
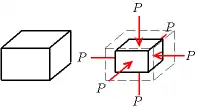
Cette définition doit être complétée car sous l'effet d'une compression les corps ont tendance à s'échauffer. On définit donc une compressibilité isotherme, pour un corps restant à température constante, et une compressibilité isentropique (ou adiabatique), pour un corps restant à entropie constante. Les deux coefficients ainsi définis sont reliés aux capacités thermiques du corps par la relation de Reech.
Le deuxième principe de la thermodynamique induit que la compressibilité d'un corps stable ne peut être que positive : le volume d'un corps doit diminuer lorsque l'on augmente la pression. Une compressibilité négative ou nulle induit un corps instable, à moins que cette instabilité ne soit compensée par d'autres phénomènes ou forces : une telle propriété est donc difficile à observer. La compressibilité est une propriété tensorielle, elle dépend de la direction dans laquelle la force de pression est appliquée. Des cas de compressibilité négative dans une (compressibilité linéaire) ou deux (compressibilité planaire) directions ont été observées expérimentalement, la trace du tenseur restant cependant positive.
La compressibilité isotherme des gaz est très élevée (10−5 à 10−6 Pa−1), elle est faible pour les liquides (10−6 à 10−10 Pa−1) et très faible pour les solides (10−10 à 10−12 Pa−1)[1].
Définitions
Coefficient de compressibilité isotherme
Le coefficient de compressibilité isotherme, que l'on note le plus souvent (le Green Book de l'UICPA, page 56, préconise la notation ), est défini par la relation :
ou encore, en fonction de la masse volumique :
avec :
- la pression ;
- la température absolue ;
- le volume ;
- la masse volumique.
Coefficient de compressibilité isentropique
Le coefficient de compressibilité isentropique, que l'on note le plus souvent (le Green Book de l'UICPA, p. 56, préconise la notation ), est défini par la relation :
avec :
- la pression ;
- l'entropie ;
- la température absolue ;
- le volume.
Relations avec les coefficients de compressibilité
Relations avec la compressibilité isotherme
Puisque l'on a la relation :
on a :
avec l'enthalpie libre.
En considérant d'autre part que :
on a :
avec l'énergie libre.
Le coefficient de compressibilité isotherme entre dans la forme différentielle du volume d'un mélange :
avec :
- le coefficient de dilatation isobare ;
- la quantité ou nombre de moles du composant ;
- le volume molaire partiel du composant .
Si les quantités de matière sont constantes on a : .
Le coefficient de compressibilité isotherme est également lié au coefficient de compression isochore par la relation :
Le coefficient de compressibilité isotherme est égal à l'inverse du module d'élasticité isostatique du milieu, généralement noté , aussi appelé module d'incompressibilité :
Le coefficient de compressibilité isotherme entre aussi dans la relation de Mayer générale :
avec :
Relations avec la compressibilité isentropique
Puisque l'on a la relation :
on a :
avec l'enthalpie.
En considérant d'autre part que :
on a :
avec l'énergie interne.
Le coefficient de compressibilité isentropique entre dans la forme différentielle du volume d'un mélange à composition constante :
avec l'un des coefficients calorimétriques (sans nom).
Ce coefficient entre dans l'expression de la vitesse du son dans un fluide :
avec la masse volumique du fluide.
Stabilité thermodynamique
Soit un système thermodynamique soumis au travail d'une pression extérieure constante. On suppose le système et le milieu extérieur à l'équilibre thermique permanent (même température) et que cette température est constante. La variation de l'énergie interne du système vaut :
À température constante, on a, en introduisant l'énergie libre :
La pression extérieure étant constante, on a :
Le deuxième principe de la thermodynamique implique que le terme , ou chaleur non compensée de Clausius, ne peut être que positif ou nul dans une transformation spontanée et par conséquent :
À température constante, lorsque le corps est soumis à une pression extérieure constante, la fonction ne peut donc que décroitre. À l'équilibre, si la fonction pouvait continuer à décroître alors toute perturbation relancerait la transformation, l'équilibre serait instable ou métastable. Toute évolution après l'équilibre ne peut par conséquent entrainer qu'une croissance de la fonction, interdite par le deuxième principe. Un équilibre stable est donc atteint lorsque la fonction atteint un minimum : la fonction ne peut plus évoluer.
La fonction ayant pour variables naturelles le volume et la température , la fonction , à température constante, a pour seule variable . Pour que l'équilibre soit stable, la fonction doit donc répondre à :
- (condition d'équilibre : la fonction ne varie plus) ;
- (condition de stabilité : la fonction est à un minimum).
La dérivée seconde doit être positive strictement. Si la dérivée seconde est nulle, l'équilibre est métastable, mathématiquement il s'agit d'un point d'inflexion de la fonction ; si elle est négative, l'équilibre est instable, il s'agit d'un maximum de la fonction.
En considérant la dérivée partielle de l'énergie libre :
on a à l'équilibre stable :
On en déduit qu'un corps à l'équilibre ne peut être stable qu'à la pression et que si sa compressibilité est positive strictement[2] :
Autrement dit, un corps ne peut être stable que si son volume diminue lorsque la pression augmente.
Un raisonnement identique à entropie constante (soit ) au lieu de température constante, en utilisant l'énergie interne à la place de l'énergie libre conduit à la condition de stabilité[2] :
La thermodynamique n'interdit pas que le volume d'un corps puisse augmenter avec une augmentation de pression, et donc que sa compressibilité soit négative. Un tel corps serait cependant instable et par conséquent difficile à observer, à moins que d'autres phénomènes ou forces que la pression compensent cette instabilité. Toutefois cette propriété est tensorielle, elle peut dépendre de la direction dans laquelle la force de pression est appliquée ; trois valeurs propres différentes peuvent être observées, le tenseur étant alors anisotrope. Des compressibilités négatives linéaires (une valeur propre) ou planaires (deux valeurs propres) ont été observées sur des mousses métalliques et des cristaux composés d'eau et de méthanol, ces phénomènes étant expliqués par l'architecture des cristaux à l'échelle moléculaire[3] - [4] - [5]. La trace du tenseur (la somme des trois valeurs propres) reste cependant positive, assurant la stabilité thermodynamique.
Relation de Reech
La relation de Reech relie le rapport des capacités thermiques au rapport des coefficients de compressibilité :
avec :
- le coefficient de Laplace (adimensionnel), utilisé dans la loi de Laplace ;
- la capacité thermique isobare (en J/K) ;
- la capacité thermique isochore (en J/K).
Puisque , la relation de Mayer montre que . Par conséquent la relation de Reech montre que :
Cas d'un gaz parfait
Dans le cas d'un gaz parfait, on applique l'équation :
avec :
- la pression ;
- le volume ;
- la quantité de matière (en moles) ;
- la constante universelle des gaz parfaits ;
- la température absolue.
On a donc :
et enfin :
Avec la relation de Reech et la relation de Mayer on a par conséquent :
avec :
- la capacité thermique isobare (en J/K) ;
- le coefficient de Laplace (adimensionnel).
Notes et références
Références
- Jean-Marie Perrier-Cornet, Marwen Moussa et Patrick Gervais, Applications des Hautes Pressions Hydrostatiques en Agroalimentaire, vol. F 3 225, Éditions techniques de l'ingénieur, (lire en ligne), p. 4.
- Olivier Bonnefoy, École nationale supérieure des mines de Saint-Étienne, « Thermodynamique » [PDF] (consulté le ), p. 49.
- Compressibilité négative, A. Fortes et al., revue La Recherche, mensuel N°451, avril 2011.
- Un matériau aux propriétés contre-intuitives, Maurice Mashaal, revue Pour la science, 25/02/2011.
- Compressibilité linéaire négative géante dans le dicyanoaurate de zinc, site du CNRS - Institut de chimie, 20 février 2013.
Bibliographie
- Gérard Lesoult, Thermodynamique des matériaux : de l'élaboration des matériaux à la genèse des microstructures, vol. TM 5, Lausanne, Presses Polytechniques Universitaires Romandes (PPUR), coll. « Traité des Matériaux », , 1073 p. (ISBN 978-2-88-074-690-2, lire en ligne), paragraphe 3.6.3.


















































![{\displaystyle \mathrm {d} U=\delta W+\delta Q=-P_{\text{ext}}\,\mathrm {d} V+\delta Q=-P_{\text{ext}}\,\mathrm {d} V+T\,\mathrm {d} S-\left[T\,\mathrm {d} S-\delta Q\right]}](https://img.franco.wiki/i/17d5e604db1228234b2270c70462c9a4ccfc046c.svg)
![{\displaystyle \mathrm {d} U+P_{\text{ext}}\,\mathrm {d} V-T\,\mathrm {d} S=-\left[T\,\mathrm {d} S-\delta Q\right]}](https://img.franco.wiki/i/c316fbba08095d101c7353603cfec150c6e7683b.svg)

![{\displaystyle \mathrm {d} \left[U-TS\right]+P_{\text{ext}}\,\mathrm {d} V=\mathrm {d} F+P_{\text{ext}}\,\mathrm {d} V=-\left[T\,\mathrm {d} S-\delta Q\right]}](https://img.franco.wiki/i/bd245f0398853cf931d9ac06759944b23704d426.svg)
![{\displaystyle \mathrm {d} \left[F+P_{\text{ext}}V\right]=-\left[T\,\mathrm {d} S-\delta Q\right]}](https://img.franco.wiki/i/da8b3781044ba8f2b8556913a3e3f48507d8e6f3.svg)

![{\displaystyle \mathrm {d} \left[F+P_{\text{ext}}V\right]\leq 0}](https://img.franco.wiki/i/96e5c5f3de6f443df41cdb996fc568bf4d3ce104.svg)

![{\displaystyle \left({\partial \left[F+P_{\text{ext}}V\right] \over \partial V}\right)_{T}=0}](https://img.franco.wiki/i/7f00786f71013d81f1772c649526212a95ad9eb9.svg)
![{\displaystyle \left({\partial ^{2}\left[F+P_{\text{ext}}V\right] \over \partial V^{2}}\right)_{T}>0}](https://img.franco.wiki/i/5e479bd8030f6cbc5660c060c04a994956a74987.svg)

![{\displaystyle \left({\partial \left[F+P_{\text{ext}}V\right] \over \partial V}\right)_{T}=-P+P_{\text{ext}}=0}](https://img.franco.wiki/i/aacab018be61f6cecef97e1048b8896ff55fe56c.svg)
![{\displaystyle \left({\partial ^{2}\left[F+P_{\text{ext}}V\right] \over \partial V^{2}}\right)_{T}=-\left({\partial P \over \partial V}\right)_{T}>0}](https://img.franco.wiki/i/a45b4c5a1c7b850ff649b8d581578335a501a358.svg)














