Pouvoir tampon des couples redox minéraux
Le pouvoir tampon redox définit en pétrologie géochimique un assemblage de minéraux et de composés qui ont pour effet apparent d'astreindre la fugacité d'oxygène à dépendre de la température. La fugacité d'oxygène correspond à la pression partielle d'oxygène mesurée à partir d'un milieu d'évolution minéralogique ou réacteur chimique de synthèse de pierres ou de roches, maintenu à pression constante[1]. La fugacité d'oxygène caractéristique permet d'ordonner ici les couples redox, du plus réducteur au plus oxydant[2].
La connaissance des potentiels des couples d'oxydoréduction minéraux en présence ou de manière équivalente, la détermination ou l'estimation des fugacités d'oxygène correspondantes, à laquelle une roche se forme ou évolue, peut être cruciale pour interpréter sa genèse et son histoire[3]. Le fer, le soufre et le manganèse figurent parmi les éléments de la croûte terrestre les plus abondants. Or ils y sont présents à différents degrés d'oxydation. Par exemple, le fer quatrième en abondance peut s'y trouver à l'état natif, à l'état ferreux (Fe2+) ou ferrique (Fe3+). Le potentiel redox d'une roche détermine effectivement les proportions relatives de l'état d'oxydation des éléments dans ces composés minéraux. Si une roche recèle des minéraux constitutifs d'un couple redox à effet tampon, alors la fugacité d'oxygène à l'équilibre est définie par des courbes ou diagramme d'équilibre de la fugacité en fonction de la température. Les autres roches à partir de minéraux adéquats peuvent être mieux connues, les fugacités d'oxygène calculées et les conditions redox obtenues par comparaison des diagrammes d'équilibre.
Effet tampon de couples redox bien connu en minéralogie
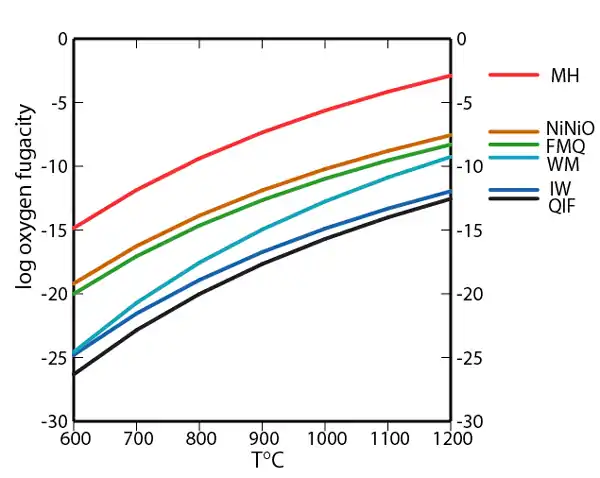
Pouvoir tampon connu
La pétrologie et la géochimie expérimentales ont permis en laboratoire de développer cette approche de pouvoir tampon, via les mesures de fugacité d'oxygène au cours de processus isobare de modélisation expérimentale, le but étant de mieux expliquer la stabilité des minéraux et l'histoire des roches qu'ils constituent par leur assemblage en équilibre. Chacune des courbes du diagramme fugacité-température caractérise une réaction d'oxydoréduction stabilisée par effet tampon. Les pouvoirs tampons des couples redox sont indiqués ci-dessous par ordre décroissant de fugacité d'oxygène à une température donnée, soit des conditions de milieu les plus oxydantes au plus réductrices dans la gamme de température. Tant que les minéraux purs ou leurs composés équivalents sont présents dans l'assemblage à pouvoir tampon, les critères d'oxydation sont déterminés par la courbe pour cet effet. Pour comprendre l'usage et la pertinence des méthodes expérimentales isobares, il faut savoir que les pressions n'ont qu'une influence très faible sur ces pouvoirs tampons dans les conditions trouvées au sein de la croûte terrestre.
- 4 Fe3O4 + O2 = 6 Fe2O3
NiNiO nickel-oxyde de nickel
- 2 Ni + O2 = 2 NiO
- 3 Fe2SiO4 +O2 = 2 Fe3O4 + 3 SiO2
WM wustite-magnétite
- 3 Fe1-xO + O2 ~ Fe3O4
IW fer-wustite
- 2(1-x) Fe + O2 = 2 Fe1-xO
QIF quartz-fer-fayalite
- 2 Fe + SiO2 + O2 = Fe2SiO4
Minéraux, roches types et pouvoir tampon des couples minéraux redox spécifiques
Remarque préalable sur le fer
Le rapport Fe2+ sur Fe3+ au sein d'une roche détermine en partie l'assemblage de silicates et d'oxydes. Une roche d'une composition chimique donnée peut contenir du fer parmi ses minéraux, que ce soit dans leurs compositions chimiques globales ou leurs phases minérales, soit du fer stable à température et pression de la roche. En milieu oxydant équilibré par le tampon redox MH (magnétite-hématite), la plupart du fer l'est sous forme Fe3+ et l'hématite est le minerai le plus favorisé au sein des roches contenant du fer. Le fer peut seulement pénétrer concrètement dans les minéraux tels que l'olivine s'il est à l'état Fe2+ ; Fe3+ ne peut rentrer dans le réseau de la fayalite ou de l'olivine. Les éléments dans l'olivine tels que le magnésium, cependant, stabilisent l'olivine contenant du Fe2+ dans des conditions plus oxydantes que celles requises pour une fayalite stable. Les solutions solides entre magnétite et ulvöspinelle, dernier membre contenant du titane, élargissent évidemment le domaine de stabilité de la magnétite. De même, en condition réductrice en équilibre tampon IW (fer-wustite), les minéraux tels que le pyroxène peuvent toujours contenir du Fe3+. La prise en compte du pouvoir tampon redox ne représente en conséquence qu'une façon bien approximative de connaître les proportions de Fe2+ et Fe3+ dans les minéraux et les roches.
Roches ignées
Les roches magmatiques cristallisent communément à des fugacités ou pressions partielles d'oxygène plus importantes ou oxydantes que le tampon redox WM (wüstite-magnétite) et surtout moins réductrices que la base zéro (log 1) soit au-dessus du tampon redox nickel Ni-oxyde de nickel NiO. Ces conditions oxydantes ne sont ainsi pas très éloignées du triple équilibre redox FMQ ou fayalite-magnétite-quartz. Néanmoins il y a toujours des différences systématiques qui les relient à une mise en place tectonique, spécifiquement locale. Les roches ignées d'origine magmatique prennent place par surgissement au niveau des arcs volcaniques insulaires en montrant des mesures de fugacité d'oxygène une ou deux unités logarithmiques, plus oxydante que le tampon Ni-NiO. Par contraste, les roches basiques, comme les basaltes et les gabbros, en dehors des arcs volcaniques donnent des fugacités de l'ordre de grandeur de celles de l'équilibre FMQ à une unité logarithmique près, voire souvent plus faibles, donc plus réductrices que ce dernier tampon redox.
Roches sédimentaires
Les conditions oxydantes se rencontrent fréquemment dans les dépôts sédimentaires, et se poursuivent au cours de la diagenèse de nombreuses roches sédimentaires. La fugacité d'oxygène caractéristique du tampon redox MH magnétite-hématite est seulement de l'ordre de 10−70 à 25 °C mais cela correspond à 0,2 atmosphère de l'atmosphère terrestre, ce qui prouve que ce milieu est bien plus oxydant que celui des magmas. Il ne faut toutefois pas oublier que d'autres environnements sédimentaires peuvent aussi être relativement réducteurs, en particulier celui des shales noirs.
Roches métamorphiques
Les fugacités d'oxygène au cours du métamorphisme grimpent à des valeurs plus élevées que celles des milieux magmatiques, parce que les compositions les plus oxydées sont souvent des héritages des dépôts sédimentaires. De l'hématite quasi-pure est bien présente dans les formations rubanées. Au contraire, du fer et du nickel natif se retrouvent dans certaines serpentinites.
Roches extraterrestres
Au sein des météorites, le couple fer-wustite semble posséder un pouvoir tampon efficace, adéquat pour décrire la fugacité de ce type de système extra-terrestre.
Équilibre redox et soufre
Les minéraux sulfurés, tels que la pyrite (FeS2) et la pyrrhotite (Fe1-xS), sont présents dans de nombreux gisements de minerais. La pyrite et son polymorphe, la marcassite, sont donc importantes dans plusieurs dépôts de charbon et de shales. Ces minéraux sulfurés se forment dans des environnements moins réducteurs qu'à la surface de la Terre. Une fois en contact avec les eaux de surface oxydantes, les sulfures réagissent, permettant la formation des sulfates, c'est-à-dire le remplacement de l'anion sulfure par l'anion SO42−[4]. Les eaux deviennent acides et chargées d'une gamme très variée d'éléments et de composés, dont certains sont potentiellement très toxiques. Les implications et conséquences à long terme pour l'œcumène sont parfois nocives, notamment concernant les eaux acides d'évacuation de mines[5].
L'oxydation du soufre en sulfate ou dioxyde de soufre apparaît importante à la suite des éruptions volcaniques produisant d'abondantes et inhabituelles quantités de soufre, telles celles du Pinatubo en 1991 et du El Chichón en 1982. Ces éruptions rejettent d'énormes quantités de gaz sulfurés ou soufrés, notamment du dioxyde de soufre, dans l'atmosphère terrestre, influençant la qualité de l'air et le climat global de la planète. Les magmas peuvent être oxydants, presque deux unités logarithmiques au-dessus du tampon redox Ni-NiO. Le sulfate de calcium, l'anhydrite sont présents comme phénocristaux au sein des éjectas libérés par l'éruption. Par contraste, les sulfures contiennent la plupart du soufre des magmas, à l'état plus réduit que l'équilibre du tampon redox FMQ.
Références
- Le traitement modélisateur emprunte à la notion de gaz parfait, la fugacité étant un facteur correctif de la pression.
- Elle représente donc indirectement une mesure du potentiel d'oxydo-réduction.
- De même, l'étude chimique des phénomènes d'oxydoréduction en phase sèche permet un classement des corps purs ou composés par pouvoir réducteur croissant, ou encore en voie humide, le classement des espèces chimiques présentes ou apparues en solution. Il reste que de telles approches descriptives, fournisseuses de données quantitatives, ignorent tout facteur cinétique ou autres phénomènes de catalyse, de méta-équilibre, d'amorçage réactif, de facteur d'encombrement local ou de pression microscopique.
- Sans rentrer dans le rôle biochimique des micro-organismes qui véritablement orientent et maîtrisent les transformations chimiques dans ses roches, encore souvent chaudes.
- Même remarque sur les pollutions souvent rémanentes des usines de traitements de métaux lourds, à commencer par le plomb ou le mercure.
Bibliographie
- Bernard Bonin, Jean-François Moyen, Magmatisme et roches magmatiques, Sciences de la Terre, Éditeur Dunod, 3e éd. 2011, 320 p. (ISBN 9782100562367). Définition de la fugacité d'oxygène et des gaz magmatiques pp 223–224.
- Donald H. Lindsley (éditeur), Oxide minerals: petrologic and magnetic significance, Mineralogical Society of America Reviews in Mineralogy, vol. 25, 509 p. (1991) (ISBN 0-939950-30-8). D'où provient les courbes du « Diagramme fugacité d'oxygène en fonction de la température ».
- Bruno Scaillet et Bernard W. Evans, The 15 June 1991 Eruption of Mount Pinatubo. I. Phase Equilibria and Pre-eruption P–T–fO2–fH2O Conditions of the Dacite Magma, Journal of Petrology, vol. 40, p. 381-411 (1999).
- H.St.C. O'Neill et V. J. Wall, The Olivine—Orthopyroxene—Spinel Oxygen Geobarometer, the Nickel Precipitation Curve, and the Oxygen Fugacity of the Earth's Upper Mantle, Journal of Petrology, vol. 28, issue 6, 1987, p. 1169-1191, DOI 10.1093/petrology/28.6.1169
- Haggerty, S. E. (1978), The redox state of planetary basalts, Geophys. Res. Lett., 5: 443–446, DOI 10.1029/GL005i006p00443
- Fabrice Gaillard, Contrôles thermodynamiques et cinétiques des états d'oxydation du fer dans les liquides silicatés magmatiques : Expérimentation, Modélisation, Applications et simulations, Géologie appliquée, université d'Orléans, 2001, Thèse
Pour aller plus loin en pétrologie
- C. Cartier, T. Hammouda, M. Boyet, M.A. Bouhifd et J.L. Devidal, Redox control of the fractionation of niobium and tantalum during planetary accretion and core formation, in Nature Geoscience, , DOI 10.1038/ngeo2195.
- Ballhaus C., Berry R.F., Green D.H. (1990), Oxygen fugacity controls in the Earth's upper mantle, Nature 348, 437-440.
- Ballhaus C., Berry R.F., Green D.H. (1991), Experimental calibration of the olivine-orthopyroxene-spinel oxygen barometer - implications for oxygen fugacity in the Earth's upper mantle. Contrib, Miner. Petrol. 107, 27-40. Résumé de l'article The Olivine—Orthopyroxene—Spinel Oxygen Geobarometer, the Nickel Precipitation Curve, and the Oxygen Fugacity of the Earth's Upper Mantle
Voir aussi
Articles connexes
- Wustite, magnétite, hématite
- Pyrite, pyrrhotite
- Minéralogie normative
- Réactions d'oxydoréduction en phase sèche, en voie humide, en phase solide-gaz
- Diagramme d'Ellingham