Oxyde de nickel(II)
L'oxyde de nickel(II) est un composé chimique ionique comportant en principe un cation de nickel pour un anion oxyde ou d'oxygène, de formule NiO.
| Oxyde de nickel(II) | |
| |
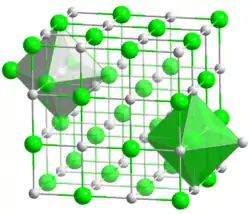
| __ Ni2+ __ O2− Structure de l'oxyde de nickel(II). |
|
| Identification | |
|---|---|
| Synonymes |
monoxyde de nickel |
| No CAS | |
| No ECHA | 100.013.833 |
| No CE | 215-215-7 |
| PubChem | 14805 |
| Apparence | poudre anhydre cristalline jaune clair très pure, gris cendré après calcination, le plus souvent vert clair à noir[1], la couleur verte ou gris-vert atteste d'un écart de stœchiométrie (excès d'oxygène) et les teintes grises et noires marquent le passage à la trivalence de l'ion Ni. Les solutions hydratées ou l'hydroxyde sont vert pomme. |
| Propriétés chimiques | |
| Formule | NiO |
| Masse molaire[2] | 74,692 8 ± 0,000 7 g/mol Ni 78,58 %, O 21,42 %, |
| Susceptibilité magnétique | +660,0 × 10−6 cm3/mol |
| Propriétés physiques | |
| T° fusion | fond à 1 984 °C[1] |
| Solubilité | dans l'eau : nulle[1] |
| Masse volumique | 6,7 g cm−3[1], 6,72 g cm−3 |
| Cristallographie | |
| Symbole de Pearson | [3] |
| Classe cristalline ou groupe d’espace | Fm3m (n°225)[3] |
| Strukturbericht | B1[3] |
| Structure type | NaCl[3] |
| Paramètres de maille | a = 4,176 9 Å ; Z = 4[4] |
| Propriétés optiques | |
| Indice de réfraction | indice nD 2,1818 (n 2,37) |
| Précautions | |
| SGH[5] | |
  Danger |
|
| SIMDUT[6] | |
 D2A, |
|
| Inhalation | Toux |
| Peau | Rougeur douleur |
| Yeux | Rougeur |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés physiques et chimiques
Ce composé cristallin, de maille cubique à faces centrées, insoluble dans l'eau, relativement dur, inodore, existe dans la nature, il s'agit du minéral bunsénite. Au laboratoire, cet oxyde basique, antiferromagnétique, cristallise également dans la structure-type cubique et isotrope du chlorure de sodium NaCl, les ions Ni(II) et O(-II) occupant des sites octaédriques. NiO est l'un des premiers isolants de Mott connus.
Comme c'est le cas pour de nombreux oxydes de métaux divalents, NiO est très fréquemment non-stœchiométrique (le rapport Ni/O est légèrement différent de 1). Cette variation explique le changement de couleur, la structure ionique équilibrée tend vers le jaune clair (NiO très pur) et le vert alors que la structure déséquilibrée par un excès d'oxygène devient verte puis gris vert et que l'apparition d'ion nickel trivalent Ni3+ donne une coloration encore plus sombre, grisée puis noire.
Chauffé lentement à l'air, il se transforme en oxyde de nickel(III) Ni2O3 à partir de 400 °C. Mais ce corps instable à la chaleur se décompose ensuite en NiO et en gaz oxygène O2.

L'oxyde de nickel juste obtenu à hautes températures, par exemple après calcination classique, est pratiquement insoluble dans les acides et les bases. Mais plus la température interne chute, plus il devient soluble.
Le corps à température ambiante est soluble dans les acides et l'ammoniaque. Il est très facilement soluble dans l'acide nitrique à chaud[7].
La dissolution en milieu aqueux engendre une couleur verte du fait de la présence des cations complexes [Ni(H2O)6]2+ vert-pomme.
La dissolution dans l'ammoniaque donne une liqueur de couleur bleue, qui s'explique par les cations complexes Ni(NH3)n2+.
Il est aussi soluble dans le cyanure de potassium aqueux. En excès de cyanures, il se forme le complexe jaune Ni(CN)42−
- Ni(CN)2 aqueux + 2 KCNen excès → K2Ni(CN)4 tétracyanonickélate de potassium jaune
Une fois les ions nickel solubilisés en milieu aqueux, l'action de la soude Na2CO3 ou de la potasse K2CO3, ou mieux de la soude caustique Na(OH) ou potasse caustique K(OH) permet de précipiter l'hydroxyde de nickel vert pomme.
L'oxyde de nickel chauffé au rouge peut être réduit en métal nickel par l'hydrogène.
- NiO solide cristal + H2courant de gaz dihydrogène → Ni métal + H2O vapeur
La réduction à chaud par le carbone, en pratique le charbon actif au laboratoire, ou le monoxyde de carbone dans l'industrie, est également utilisée pour obtenir le corps simple Ni. Porté à la température d'un feu de forge avec du charbon, l'oxyde de nickel donne le corps simple métal nickel.
Chauffé à plus de 700 °C avec de l'oxyde de sodium ou de l'oxyde de potassium, l'oxyde de nickel donne des ions nickélates en milieu fondu.
L'oxyde de nickel réagit avec l'oxyde de chrome trivalent, en présence d'eau et d'alcali, pour donner le chromate de nickel, des procédés électro-chromiques.
- 2 Cr2O3 + 4 NiO + 3 O2 gaz→ 4 NiCrO4
Préparation
L'oxyde peut être obtenu directement par chauffage à l'air du nickel métal en poudre.
- 2 Ni poudre métallique + O2chauffage à l'air au-dessus de 400 °C → NiO oxyde de nickel gris à noir non-stoechiométrique, poudreux
Il peut être obtenu par oxydation modérée de la nickéline ou NiAs naturel.
Certains procédés commerciaux partent d'un mélange de poudre de nickel et d'eau, chauffé en autoclave ou milieu fermé à 1 000 °C en utilisant de l'oxyde de nickel déjà préparé comme accélérateur de réaction.
Mais la méthode la plus simple au laboratoire consiste en la pyrolyse ou calcination forte de nombreux composés du nickel divalent comme Ni(OH)2, Ni(NO3)2 ou NiCO3[8]. L'oxyde de nickel peut être obtenu chimiquement pur.
Des milliers de tonnes d'oxyde de nickel, matière plus ou moins impures, sont produits annuellement dans le monde, comme intermédiaire de la métallurgie du nickel.
Toxicologie
Il s'agit d'un produit toxique et cancérigène[9]. La poussière résultant des fumées ou vapeurs s'attaque au système respiratoire, produisant de graves lésions irréversibles. Il est surtout encore plus toxique à l'état finement divisé et chaud.
Usages
En chimie de spécialités, l'oxyde de nickel noir est un précurseur de nombreux sels de nickel, à partir de traitement par des acides minéraux, et de catalyseurs à base de nickel, notamment d'hydrogénation.
Il s'agit d'un pigment vert des céramiques et des verres (à froid), qui devient jaune à chaud. Il peut être présent dans le verre fritté, les glaçures de céramiques et de porcelaines, ainsi que les ferrites.
Les oxydes frittés sont employés pour produire des aciers alliés plus ou moins fortement au nickel, après réduction contrôlée au monoxyde de carbone. Charles Édouard Guillaume a reçu en 1920 le prix Nobel de physique pour la mise au point des alliages spéciaux, que sont l'invar ou l'élinvar, aux remarquables propriétés physiques.
Si l'oxyde de nickel était un composant des accumulateurs Ni-Fe, dénommée autrefois « batterie d'Edison », il sert toujours dans les piles à combustible ainsi que dans les batteries au nickel-cadmium rechargeables, ces derniers il est vrai remplacés par les piles rechargeables NiMH. L'oxyde de nickel est un matériau de l'anode des techniques électro-chromiques.
Références
- OXYDE DE NICKEL(II), Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « The NaCl (B1) Structure », sur http://cst-www.nrl.navy.mil/ (consulté le )
- R.W. Cairns, E. Ott: X-Ray Studies of the System Nickel-Oxygen-Water. I. Nickelous Oxide and Hydroxide. In: Journal of the American Chemical Society, Numéro55, 1933, page 527–533, DOI 10.1021/ja01329a013.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Monoxyde de nickel » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- Georg Brauer, opus cité Handbuch der Präparativen Anorganischen Chemie, Tome III, page 1689, Ferdinand Enke Verlag Stuttgart 1981, (ISBN 3-432-87823-0)
- La réaction est plus ou moins exothermique. Il se dégage respectivement de la vapeur d'eau, du dioxyde d'azote et du dioxygène, du dioxyde de carbone.
- "Toxicology and Carcinogenesis Studies of Nickel Oxide", U.S. Departement of Health and Human Services, No. 451, 07/1996
Bibliographie
- Georg Brauer, Handbuch der Präparativen Anorganischen Chemie, Tome III, page 1689, Ferdinand Enke Verlag Stuttgart 1981, (ISBN 3-432-87823-0)
- Norman N. Greenwood, Alan Earnshaw, Chemistry of the elements, Pergamon Press, Oxford, 1984, pp. 1336–37. (ISBN 0-08-022057-6).
- K. Lascelles, L. G. Morgan, D. Nicholls, D. Beyersmann article "Nickel Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, cinquième édition, Wiley-VCH, Weinheim, 2005, Tome A 17, pp 235–249. Lire aussi "nickel" page 157 et "nickel alloys" page 221
- Pradyot Pradniak (dir.), "Handbook of Inorganic Chemicals", McGraw-Hill Publications, 2003, (ISBN 0-07-049439-8)
Autres sources
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Nickel(II) oxide » (voir la liste des auteurs).
