Phtalate acide de potassium
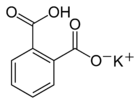
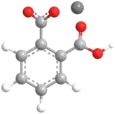
Le phtalate acide de potassium est le sel monopotassique de l'acide benzène-1,2-dicarboxylique (acide phtalique). On le trouve également sous les sigles KAP (Potassium Acid Phthalate) et KHP (Potassium Hydrogen Phthalate). Défini comme étalon primaire pour la préparation des solutions étalons de bases fortes[1], il est également utilisé pour la définition de l'échelle de pH[2] . Les cristaux de phtalate acide de potassium (KAP) sont utilisés comme cristaux monochromateur ou analyseur en spectrographie des rayons X de grande longueur d'onde.
| Phtalate acide de potassium | |
  |
|
| Identification | |
|---|---|
| Nom UICPA | 2-carboxybenzoate de potassium |
| Synonymes |
phtalate acide de potassium, hydrogénophtalate de potassium, biphtalate de potassium, KHP, KAP |
| No CAS | |
| No ECHA | 100.011.718 |
| No RTECS | CZ4326000 |
| PubChem | 23676735 87574540 |
| SMILES | |
| InChI | |
| Apparence | Solide cristallin blanc et inodore |
| Propriétés chimiques | |
| Formule | C8H5KO4 [Isomères] |
| Masse molaire[3] | 204,221 2 ± 0,008 1 g/mol C 47,05 %, H 2,47 %, K 19,15 %, O 31,34 %, |
| pKa | 5,4[4] |
| Propriétés physiques | |
| T° fusion | 295-300 °C -déc[5]. |
| Solubilité | 80 g·L-1[5] |
| Masse volumique | 1,632 g·cm-3[5] |
| Propriétés électroniques | |
| Constante diélectrique | 238[6] |
| Cristallographie | |
| Système cristallin | orthorhombique[7] |
| Classe cristalline ou groupe d’espace | mm2[8], (no 29) [7]
|
| Paramètres de maille | a = 9,62 Å b = 13,26 Å |
| Volume | 858,921 Å3[10] |
| Précautions | |
| SGH[11] | |
 |
|
| Écotoxicologie | |
| DL50 | 3 200 mg·kg-1 (rat, oral)[5] |
| LogP | 1,415 (octanol/eau)[5] |
| Composés apparentés | |
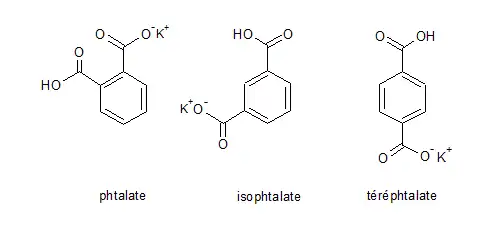
| Isomère(s) | isophtalate, téréphtalate |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés
Stabilité thermique
L'étude de la stabilité thermique par thermogravimétrie du KAP montre qu'il se décompose par chauffage[6] - [12] - [13] à partir de 255 °C en phtalate dipotassique . Ce dernier est ensuite dégradé en et un produit de carbonisation à 800 °C.
Propriétés spectroscopiques
| Tableau de données IR - Raman - RMN 1H - RMN 13C | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||
Propriété piézoélectrique
Le coefficient piézoélectrique (d33) est égal à 0.36 pC/N[20].
Optique non linéaire
Des cristaux de KHP irradiés avec un laser Nd:YAG émettant un rayon de longueur d'onde de 1064 nm, permettent l'observation d'une radiation verte de longueur d'onde 532 nm qui confirme la génération d'une seconde harmonique (GSH)[21]. Ce phénomène d'optique non linéaire est utilisé pour créer des pointeurs laser de différentes couleurs.
Propriété ampholyte
L'hydrogénophtalate de potassium possède en même temps un groupe fonctionnel carboxyle et sa base conjuguée . Il peut donc être un acide et à la fois une base, c'est ce que l'on nomme un ampholyte. Cette particularité permet de l'utiliser comme substance tampon.
Propriété acide : pKa = 2,95
Propriété basique : pKa = 5,41
Utilisations
Étalonnages
LE KHP est considéré comme un étalon primaire pour les réactions acido-basiques car il respecte les conditions suivantes[22] :
- facile à obtenir, sécher et purifier;
- ne se modifie pas à l'air par oxydation ou hygroscopie;
- son taux d'impureté peut être compris entre 0,1 et 0,2%;
- sa masse molaire est élevée et réduit les imprécisions de pesée;
- réagit totalement (K >104), stœchiométriquement et rapidement;
- facilement soluble.
Étalonnage par dosage des bases (hydroxyde de sodium) [23] - [24]
Le KHP est utilisé pour la définition de l'échelle de pH[2] - [25] par l'IUPAC en 1983 à la suite de la British Standards Institution en 1961[26] - [27].
Les solutions tampons de KHP sont définies très précisément[28] et couvrent une gamme de pH de 2,2 à 5.9. L'effet tampon est le plus élevé aux environs de pH=4, la composition de ces solutions est indiquée dans le règlement CE[29].
Spectrométrie de rayons X
Les cristaux de KAP sont utilisés en tant que cristal monochromateur (filtre le faisceau incident polychromatique) de spectromètres à rayons X à dispersion de longueur d'onde[30] - [31].
- réflexion utilisée 1010
- 2d : 2,663 nm
- domaine d'analyse (angle de Bragg compris entre 12 et 55°)[32] :
| nm | K | L | M |
|---|---|---|---|
| 0,554 à 2,181 | F-P | Mn-Mo | La-Hg |
Catalyseur
Le KHP est utilisé comme catalyseur dans des réactions de synthèse héterocyclique de dérivés pyraniques ou isoxazoliques[33].
Caractérisation du carbone organique total ou dissous
Le KHP est utilisé pour l'étalonnage des appareils de mesure du Carbone Organique Total (COT) et de la Demande Chimique en Oxygène (DCO)[34].
Le principe de la mesure de la DCO peut être résumé par le bilan suivant : [35] - [36]. Une solution de 425 mg de KHP par litre d'eau distillée correspond à une DCO de 500μgO2/mL[37].
Concernant la détermination du COT (présence de molécules organiques aromatiques par exemple), elle peut s'obtenir à partir de mesures d'absorbance UV[38]. Il existe une corrélation entre la concentration de carbone d'un échantillon et celle d'une solution de référence de KHP[39], elle est donnée par cette formule . UV254 est l'absorbance en cm-1 (Standard Methods APHA, AWWA et WEF 1998) et KHP est une concentration exprimée en mg.L-1.
Isomérie
Le phtalate acide de potassium possède deux isomères de position du fait de la position des groupes carboxyle sur le cycle benzénique. Les deux groupements carboxyles sont en position méta pour l'isophtalate et en position para pour le téréphtalate.
Références
- Douglas A. Skoog, Donald M. West et F. James Holler, Chimie analytique, De Boeck Supérieur, , 996 p. (ISBN 978-2-8041-2114-3, lire en ligne)
- (en) A. K. COVINGTON, IUPAC, « Definition of pH scales, standard reference values,measurement of pH and related terminology », Pure & Appi. Chem., vol. 55, no 9, , p. 1467-1476 (lire en ligne)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche de données de sécurité » [PDF], sur www.scbt.com (consulté le )
- « Fiche de données de sécurité » [PDF] (consulté le )
- (en) « Effect of Mg2+ dopant on structural, optical and mechanical properties of potassium acid phthalate (KAP) single crystals », sur www.academia.edu (consulté le )
- (en) « The crystal structure of potassium acid phthalate, KC6H4COOH.COO » (consulté le )
- (en) « Elasto-optic studies on potassium acid phthalate single crystal » (consulté le )
- (en) « Effect of divalent metal ions on the structure, optical and mechanical properties of KAP single crystals » [PDF] (consulté le )
- (en) « Enhancement of Optical, Thermal and Mechanical Properties of Kap Crystals by Magnesium Doping » [PDF] (consulté le )
- (en) « Potassium Hydrogen Phthalate » (consulté le )
- (en) P. Kanchana, A. Elakkina Kumaran, Y. Hayakawa et C. Sekar, « Effect of divalent metal ion impurities (Ba2+, Ca2+ and Mg2+) on the growth, structural and physical properties of KAP crystals », Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, vol. 103, , p. 187–192 (DOI 10.1016/j.saa.2012.10.051, lire en ligne, consulté le )
- (en) A. E. Newkirk et Renette Laware, « Thermogravimetric analysis of potassium hydrogen phthalate », Talanta, vol. 9, , p. 169–173 (DOI 10.1016/0039-9140(62)80039-3, lire en ligne, consulté le )
- (en) « Synthesis, growth, structure and characterization of potassium lithium hydrogen phthalate mixed crystals » [PDF] (consulté le )
- (en) « Synthesis and crystal structure of potassium hydrogen phthalate mixed crystal K0.78Na1.22[C6H4(COO)2]·H2O » [PDF] (consulté le )
- (en) « Potassium hydrogen phthalate(877-24-7)Raman », sur www.chemicalbook.com (consulté le )
- (en) R. K. Raju, « Effect of NaCl Doping on Growth, Characterization, Optical and Dielectric Properties of Potassium Hydrogen Phthalate (KHP) Crystals », Advances in Materials Physics and Chemistry, no 5, , p. 399-407 (10.4236/ampc.2015.510040)
- (en) « Potassium hydrogen phthalate(877-24-7)1HNMR », sur www.chemicalbook.com (consulté le )
- (en) « Potassium hydrogen phthalate(877-24-7)13CNMR », sur www.chemicalbook.com (consulté le )
- (en) « A study on the growth, optical, thermal, mechanical, dielectric and piezoelectric properties of dye doped KAP single crystals » [PDF] (consulté le )
- (en) R. K. Raju, S. M. Dharamaprakash et H. S. Jayanna, « Effect of NaCl Doping on Growth, Characterization, Optical and Dielectric Properties of Potassium Hydrogen Phthalate (KHP) Crystals », Advances in Materials Physics and Chemistry, vol. 05, , p. 399–407 (DOI 10.4236/ampc.2015.510040, lire en ligne)
- (en) « Analyse chimique quantitative de Vogel » (consulté le )
- (en) Quality control methods for herbal materials, World Health Organization, , 173 p. (ISBN 978-92-4-150073-9, lire en ligne), p. 119-120
- (en) OxyChem®, Hydrochloric Acid Handbook, OxyChem®, , 51 p. (lire en ligne), p. 44-45
- (en) Hannah B. Hetzer, Richard A. Durst, R. A. Robinson et Rogger G. Bates, Standard pH values for the potassium hydrogen phthalate reference buffer solution from 0 to 60 degrees C., National Bureau of Standards, (lire en ligne)
- (en) A. M. James et Cecil Whitfield Davies, A Dictionary of Electrochemistry, Springer, (ISBN 978-1-349-02820-7, lire en ligne)
- (en) E. B. Jones, On-Line Analysis Instrument : Instrument Technology, Butterworth-Heinemann, , 290 p. (ISBN 978-1-4831-4472-6, lire en ligne)
- (en) OECD, OECD Guidelines for the Testing of Chemicals : Section 1 : Physical-Chemical properties Test No. 111 : Hydrolysis as a Function of pH, OECD Publishing, , 16 p. (ISBN 978-92-64-06970-1, lire en ligne)
- Liste et description des méthodes d'analyses visées à l'article 120 octies, premier alinéa, du règlement (CE) no 1234/2007 du Conseil, Journal officiel de l’Union européenne, , 60 p. (lire en ligne [PDF]), p. 43« Solution 0,05 M de phtalate acide de potassium. Solution contenant 10,211 g/l de phtalate acide de potassium (C8H5KO4), à 20 °C. (Durée maximale de conservation: 2 mois). pH = 3,999 à 15 °C, 4,003 à 20 °C, 4,008 à 25 °C, 4,015 à 30 °C »
- (en) D. Chopra, « X‐Ray Spectrometric Characteristics of Potassium Acid Phthalate Crystals », Review of Scientific Instruments, vol. 41, , p. 1004–1006 (ISSN 0034-6748 et 1089-7623, DOI 10.1063/1.1684684, lire en ligne, consulté le )
- Microanalyse X par Sonde Electronique, Ed. Techniques Ingénieur (lire en ligne), p. 885v2 - 8
- Microscopie électronique à balayage et microanalyses (lire en ligne)
- (en) Hamzeh Kiyani et Fatemeh Ghorbani, « Efficient tandem synthesis of a variety of pyran-annulated heterocycles, 3,4-disubstituted isoxazol-5(4H)-ones, and α,β-unsaturated nitriles catalyzed by potassium hydrogen phthalate in water », Research on Chemical Intermediates, vol. 41, , p. 7847–7882 (ISSN 0922-6168 et 1568-5675, DOI 10.1007/s11164-014-1863-7, lire en ligne, consulté le )
- (en) « 5220 CHEMICAL OXYGEN DEMAND (COD)* »
- (en) C. A. Brebbia et J. S. Antunes do Carmo, Water Pollution VIII : Modelling, Monitoring and Management, WIT Press, , 651 p. (ISBN 978-1-84564-042-2, lire en ligne)
- (en) Wayne Boyles, The Science of CHEMICAL OXYGEN DEMAND, vol. 9, Hach Company, , 24 p. (lire en ligne), p. 6-8
- (en) Government of India & Government of The Netherlands, Standard Analytical Procedures for Water Analysis - May 1999, , 80 p., p. 17-18
- (en) Chihoon Kim, Joo Beom Eom, Soyoun Jung et Taeksoo Ji, « Detection of Organic Compounds in Water by an Optical Absorbance Method », Sensors, vol. 16, , p. 61 (PMID 26742043, PMCID 4732094, DOI 10.3390/s16010061, lire en ligne, consulté le )
- (en) AWWA Staff et Water Research Foundation Staff, Online Monitoring for Drinking Water Utilities, American Water Works Association, (ISBN 978-1-61300-183-7, lire en ligne)
Voir aussi
Articles connexes
Composés structurellement ou chimiquement apparentés :










