Nitrure d'uranium
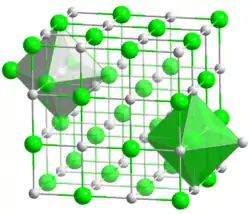
Le nitrure d'uranium est un composé chimique de formule UN. C'est un solide gris cristallisé selon une structure de type sel gemme.
| Nitrure d'uranium | |
| |
| __ U3+ __ N3− Structure du nitrure d'uranium |
|
| Identification | |
|---|---|
| Nom UICPA | Nitrure d'uranium |
| Synonymes |
Nitrure d'uranium(III) |
| No CAS | [1] |
| Apparence | Solide cristallin gris |
| Propriétés chimiques | |
| Formule | UN |
| Masse molaire[2] | 252,035 6 ± 0,000 2 g/mol N 5,56 %, U 94,44 %, |
| Propriétés physiques | |
| T° fusion | 2 630 °C[1] |
| Solubilité | insoluble |
| Masse volumique | 14 300 kg·m-3[1] |
| Cristallographie | |
| Système cristallin | Cubique |
| Structure type | Halite |
| Précautions | |
 Composé radioactif |
|
| SGH[3] | |
   Danger |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Intérêt des nitrures d'actinides par rapport aux oxydes
Les nitrures d'actinides (notamment d'uranium, de plutonium, voire d'américium) présentent certains avantages sur les oxydes en tant que combustibles nucléaires, notamment une densité d'atomes fissiles plus élevée et une meilleure conductivité thermique, et peuvent être recyclés par traitement pyrochimique[4]. Le CEA a investigué, dans les années 1970 et 1980, les procédés industriels permettant de produire des nitrures d'actinides par réduction carbothermique d'oxydes sous atmosphère d'azote puis décomposition des nitrures d'ordre supérieur.
Les nitrures d'uranium et de plutonium sont notamment étudiés par la NASA pour leurs applications spatiales.
Inconvénients des nitrures
Les nitrures d'actinides présentent néanmoins comme difficulté de générer, lorsqu'ils sont soumis aux radiations résultant des réactions nucléaires, du carbone 14 à partir de l'azote constituant le nitrure, dans la mesure où l'azote naturel est constitué à 99,634 % de l'isotope 14N, qui donne précisément du 14C dans ces conditions. La solution consisterait à n'incorporer que l'isotope 15N dans le nitrure, mais cela accroîtrait le coût de revient du nitrure d'uranium de façon rédhibitoire.
Pour cette raison, la technologie nucléaire reposant sur les nitrures d'actinides fissiles n'a pas encore atteint la maturité.
Références
- (en) « WebElements Periodic Table » Uranium » uranium nitride », sur webelements.com (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Trends in the nuclear fuel cycle: economic, environmental and social aspects – Nuclear development, pages 91 à 93, par l'Agence de l'énergie nucléaire de l'OCDE – OECD Publishing, 2001 – (ISBN 9264196641), 9789264196643.