Nitrate de cobalt(II)
Le nitrate de cobalt(II) est un composé chimique de formule Co(NO3)2. Il se rencontre le plus souvent sous forme d'hexahydrate Co(NO3)2·6H2O, qui est un sel déliquescent rouge brun soluble dans l'eau et d'autres solvants polaires. On l'obtient en faisant réagir du carbonate, de l'hydroxyde ou de l'oxyde de cobalt avec de l'acide nitrique HNO3 :
| Nitrate de cobalt(II) | |
-nitrate-hexahydrate-sample.jpg.webp)
| |
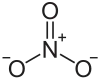 Structure du nitrate de cobalt(II) |
|
| Identification | |
|---|---|
| Synonymes |
nitrate cobalteux |
| No CAS | (anhydre) (hexahydrate) |
| No ECHA | 100.030.353 |
| No CE | 233-402-1 (anhydre) |
| PubChem | 25000 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | CoN2O6 |
| Masse molaire[1] | 182,943 ± 0,002 2 g/mol Co 32,21 %, N 15,31 %, O 52,47 %, |
| Propriétés physiques | |
| Solubilité | 1 330 g·l-1[2] à 20 °C, 2 170 g·cm-3[2] à 100 °C |
| Masse volumique | 2,49 g·cm-3[2] (anhydre) 1,88 g·cm-3 (hexahydrate) |
| Précautions | |
| SGH[2] | |
  Danger |
|
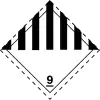
| Transport[2] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Il existe plusieurs degrés d'hydratation du nitrate de cobalt(II), représentés par la formule générique Co(NO3)2·nH2O où n = 0, 2, 4, 6.
Le nitrate de cobalt(II) anhydre adopte une structure polymérique tridimensionnelle en réseau dans laquelle chaque ion cobalt Co2+ est coordonné à six atomes d'oxygène dans une géométrie octaédrique. Chaque ion nitrate est coordonné à trois ions cobalt. Le dihydrate est un polymère bidimensionnel comportant des ponts de nitrate entre les centres Co2+ et des ponts hydrogène assurant la liaison des feuillets de nitrate de cobalt. Le tétrahydrate est constitué de molécules discrètes [(H2O)4Co(NO3)2] à géométrie octaédrique. L'hexahydrate est mieux décrit comme nitrate d'hexaaquacobalt(II) car il consiste en des ions [Co(OH2)6]2+ et [NO3]− discrets.
Les utilisations principales du nitrate de cobalt(II) conduisent généralement à le réduire en cobalt métallique ou à le faire précipiter sur divers substrats dans le cadre de la catalyse du procédé Fischer-Tropsch.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Cobalt(II) nitrate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 2 février 2013 (JavaScript nécessaire)

![{\displaystyle \mathrm {\ \!\ {\Biggr ]}} \ \mathrm {\ {\Biggl [}} }](https://img.franco.wiki/i/3dac345c821cb822697be40fb5ebb2960f01c627.svg)
![{\displaystyle \mathrm {\ \!\ {\Biggr ]}_{2}^{-}} }](https://img.franco.wiki/i/9256af4564b238218bfa888448b20ebf4d44e6dc.svg)