Nénuphar jaune
Nuphar lutea
.jpg.webp)
| Règne | Plantae |
|---|---|
| Sous-règne | Tracheobionta |
| Division | Magnoliophyta |
| Classe | Magnoliopsida |
| Sous-classe | Magnoliidae |
| Ordre | Nymphaeales |
| Famille | Nymphaeaceae |
| Genre | Nuphar |

LC : Préoccupation mineure
Monde, Europe, France
Le Nénuphar jaune ou nénufar jaune[1] parfois appelé aillout d'eau ou plateau (Nuphar lutea) est une plante herbacée de la famille des Nymphaeaceae. C'est le nénuphar sauvage d'Europe de l'Ouest et l'une des espèces nord-américaine.
Il en existe des sous-espèces[2].
Les herbiers de nénuphars accueillent de nombreuses espèces et sont souvent fréquentés par des bancs d'alevins qui y trouvent de la nourriture et des caches.
Histoire
En 1854, Trécul présente à l'Académie des sciences une étude comparant l'anatomie et la croissance de cette espèce à d'autres espèces (Victoria regia, Nelumbium)[3].
Habitats
Il vit dans les eaux douces tempérées, à courant lent ou stagnantes et ne supporte pas les eaux très polluées, très alcalines ni très acides, ce qui lui donne une certaine valeur bioindicatrice[4]. Il a besoin d'un ensoleillement important.
Description
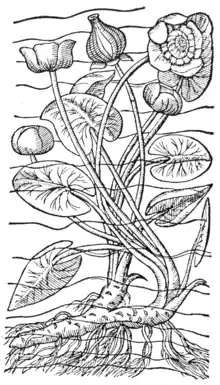
Lithographie tirée du Rariorum plantarum (1601) par Charles de l'Écluse ou Clusius (1526-1609)

C'est une plante aquatique des eaux douces, stagnantes ou lentes.
Les feuilles submergées sont plus pâles et fragiles, les feuilles flottantes sont épaisses.
Ses racines et ses rhizomes sont fixés dans le sédiment alors que le limbe des feuilles repose (flotte) à la surface de l'eau.
La fleur prépare son développement sous l'eau, mais s'épanouit hors d'eau. Elle est visitée par de nombreux insectes mais n'est fécondée que par quelques-uns ou une seule espèce (Donacia piscatrix pour la sous-espèce texane Nuphar lutea subsp. macrophylla)[2].
Dans les eaux eutrophes, les tiges et feuilles subaquatiques se couvrent rapidement de périphyton (algues filamenteuses, diatomées épiphytes, bryozoaires et autres microorganismes aquatiques)[5]. Les diatomées épiphytes observées chez cette espèce semblent être les mêmes que chez Nymphaea alba, qui partage souvent le même habitat[6].
Cycle de vie et dispersion

Ce nénuphar peut se reproduire de deux manières :
- d'une part par graines (reproduction sexuée). La diffusion des graines à distance se fait théoriquement par hydrochorie, endozoochorie et épizoochorie[7], l'hydrochorie étant cependant très peu efficace chez ce nénuphar, par rapport à Nymphoides peltata et Nymphaea alba, en raison d'une mauvaise flottabilité des carpelles et de graines relativement lourdes[7].
De plus, des graines de nénuphar jaunes expérimentalement données à des carpes communes (Cyprinus carpio) et à des Canards colverts (Anas platyrhynchos L.) et foulques (Fulica atra L.) ont toutes été digérées, contrairement à des graines d'autres plantes aquatiques partageant le même habitat, telles que Potamogeton natans, Potamogeton obtusifolius et Potamogeton pectinatus qui elles peuvent donc plus facilement coloniser des points d'eau éloignés les uns des autres[7]. En 2008 une étude basée sur l'analyse génétique de 10 marqueurs microsatellites dans des échantillons prélevés dans 44 sites différents des bassins versants des rivières Cidlina et Mrlina Labe (en République tchèque) a confirmé que les cours d'eau sont effectivement d'assez mauvais corridors de dispersion à longue distance pour cette espèce, malgré le fait que des semences soient communément dispersées selon les auteurs sur des distances de l'ordre de dizaines de kilomètres[8] (dans ce cas « un seul génotype multilocus a été trouvé dans plus d'un site d'échantillonnage, la distance entre les sites était d'environ 75 km »)[8]. L'analyse génétique montre néanmoins l'existence d'échanges génétique le long des rivières (plutôt en aval où une diversité génétique légèrement supérieur a été observée) et entre les deux cours d'eau[8]. La fleur jaune (sépales, pétales et étamines) réverbère la lumière solaire dans le spectre UV, ce qui pourrait jouer un rôle d'attraction de certains pollinisateurs, avec une signature de réémission (réflectance dans l'ultraviolet) différente de chez Nymphaea alba[9] ; chez les deux espèces dans l'UV, un cercle réfléchissant est formé par les anthères ou les filaments des étamines, mais chez Nymphaea alba ce cercle provient du contraste entre les anthères réfléchissant les UV et les pétales et les filaments qui au contraire absorbent les UV, alors que chez le nénuphar jaune, ce contraste provient des filaments qui sont hautement réfléchissant pour les UV alors que le disque stigmatique les absorbe.
- d'autre part par croissance et éventuelle division du rhizome (reproduction asexuée, aussi dite « végétative »). Les capacités de dispersion de ce nénuphar semblent donc médiocres.
La partie "verte" de la plante meurt en hiver et se reconstitue à partir du rhizome au printemps suivant. Les feuilles se décomposent beaucoup plus vite dans une eau eutrophe et alcaline que dans une eau acide et oligotrophe[10].
Comme pour l'Iris jaune, la colonisation via les graines semble souvent difficile. Par exemple un suivi de recolonisation d'un morceau non navigué du canal du Rhône a montré que ce processus était lent[11], et que si environ 600 graines avait été produites sur 1 m2 occupés par ce nénuphar, aucune germination n'a été observée durant les 5 ans d'expérimentation[11]. Les auteurs n'ont pas dans ce cas trouvé d'explication environnementale à l'absence de germination[11]. Dans ce cas le poids spécifique de la graine (1.24) était proche de celui du sédiment (1.26)[11]. Une explication fréquente pourrait être que le sédiment moderne est souvent très lâche et facilement remises en suspension dans l'eau, ce qui enfonce la graine trop profondément (à plusieurs cm) pour que la plantule puisse lever [11]. De nombreuses populations ne croissent que par multiplication végétative du réseau de rhizome (au détriment de la diversité génétique intraspécifique).
Biologie
Le nombre de feuilles flottantes, la vitesse de croissance de la plante et la qualité des feuilles flottantes varie considérablement selon la qualité de l'eau[12](température, eutrophisation, pollution) et selon caractère acide ou alcalin (les feuilles se cassent par exemple plus facilement en milieu alcalin[12].).
Le nénuphar peut dans une certaine mesure adapter sa croissance à la pression d'herbivorie[13]. Il peut coloniser les étangs construits par les castors avec leurs barrages.
Cette plante fait preuve de capacités allélopathiques, qui lui permettent de former de grands herbiers monospécifiques subaquatiques et à feuilles partiellement flottantes[14]. R Sütfeld et al. ont montré en 1996 que le tout jeune nénuphar produit de grandes quantités (jusqu'à 15 nmol/plant/jour) de résorcinol (1,3-dihydroxybenzène)[15]. C'est même l'un des principaux constituants des exsudats produits par la plante au moment de la germination de la graine en conditions axéniques (avec une corrélation inverse observée entre le taux de nitrate et/ou la fourniture de la lumière et la production de résorcinol)[15]. Le résorcinol est un composé écotoxique et probablement dans ce cas allélochimique : il contribuerait à empêcher d'autres macrophytes concurrentes pour l'espace ou les nutriments[15]. Il se montre également in vitro écotoxique pour le zooplancton et pourrait donc peut-être protéger la plantule de certains prédateurs herbivores, mais il ne se montre pas phytotoxique pour les cyanophyceae et Chlorophyceae[15].
Comme de nombreuses plantes de zones humides ou aquatiques[16], il peut bioaccumuler (à partir de l'eau ou du sédiment[17]) des contaminants environnementaux, avec un rythme saisonnier très marqué, comme cela a été montré pour les radionucléides de la série de l'uranium[18]. Ces contaminants peuvent être saisonnièrement stockés et accumulés dans le rhizome ou être principalement foliaire (comme dans le cas du radium étudié chez une espèce proche[17], radium qui accéléré la sénescence des feuiles[17] et qui est (en conditions expérimentales) principalement absorbé par la feuille à partir de l'eau et non par les racines ou le rhizome[17]). Plusieurs études ont porté sur sa capacité à concentrer des éléments rares (dont le scandium et l'yttrium, avec des résultats contradictoires[19]. Ce nénuphar peut bioaccumuler certains polluants libérés dans l'eau ou accumulés dans le sédiment (cuivre par exemple[20]).
Autres espèces de nénuphars
- Morène ou Petit nénuphar — Hydrocharis morsus-ranae
- Nénuphar blanc — Nymphaea alba
- Nénuphar bleu — Nymphaea caerulea
Utilisations
Usages alimentaires
Selon l'ethnobotaniste François Couplan[21], le long pétiole (qui peut largement mesurer plus d'un ou deux mètres) a été autrefois consommé en Europe.
Le rhizome contient des substances très amères, mais qui peuvent être éliminées par des cuissons successives dans des eaux différentes. Le rhizome du nénuphar jaune (Nuphar lutea) était ainsi mangé en Europe du nord (Finlande, Russie, Pologne) et il pouvait être séché pour être conservé[21]. En Bosnie il y a peu, on l'utilisait en bouillie et pains. Les autochtones du nord de l'Amérique mangeaient le rhizome d'une espèce proche, locale : N advena[21].
Fleurs : Les turcs utilisaient sa fleur jaune pour fabriquer une boisson rafraichissante[21].
Graines : elles sont comestibles, transformées en farine ou cuites à l'eau après être cassées, consommées en bouillies ou « pains ». Elles s'expansent à la chaleur (à la manière du Pop-corn si on les passe à la poêle dans de l'huile, ou dans la braise (enveloppées dans du papier aluminium)[21].
Ces graines sont cependant difficiles à extraire du fruit. Les autochtones d'Amérique disposaient les fruits mûrs dans le sol (dans un trou) et les laissaient pourrir jusqu'à ce que les graines puissent être facilement récupérées pour être lavées.
Les graines d'une espèce proche (N pumila) trouvée en Europe du nord et en Europe centrale semblent également comestibles selon F Couplan (2009)[21].
Usage médicinal
La plante renferme un alcaloïde (nupharine) aux vertus antispasmodiques et hypotensives[21].
Pressions, menaces
Ce n'est pas une espèce menacée à échelle mondiale, mais elle est localement en régression, et souvent victime des bateaux à moteurs et de la destruction ou dégradation des zones humides[21].
Malgré des tentatives (parfois réussies) de renaturation de flore subaquatique[22], cette espèce fait partie des macrophytes à feuilles submergées et/ou flottantes qui pour des raisons encore mal comprises semblent régresser ou disparaitre de nombreux lacs depuis plus d'un siècle[23].
Cette plante est soumise à une prédation ou diverses dégradations par divers animaux herbivores (dont élan, rat musqué, ragondin, carpes...). Elle est en contact avec des champignons aquatiques et de nombreuses bactéries et particules virales de l'eau et du sédiment ; elle s'en défend par la production de molécules défensives dont de plus d'une vingtaine d'alcaloïdes [24] - [25] qui pourraient aussi avoir un rôle allélopathique (inhibition de la croissance d'espèces concurrentes pour l'espace)[26]. Elle est néanmoins vulnérable (en surface) à la larve d'un coléoptère de la famille des Chrysomelidae, le Dendroctone du nénuphar Galerucella nymphaeae (= Pyrrhalta nymphaeae) (L.), qui serait son principal herbivore [27]. Quand le nénuphar est très attaqué par ce coléoptère, il produit plus de feuilles immergées et moins de feuilles flottantes[27].
Dans la culture
Le drapeau de la province de Frise est orné de sept feuilles de nénuphar jaune.
Notes
Références
- l'Académie française a écrit nénufar jusqu'en 1935 et le Rapport de 1990 sur les rectifications orthographiques (Liste H) préconise de revenir à cette graphie
- Schneider, E. L., & Moore, L. A. (1977). Morphological studies of the Nymphaeaceae. VII. The floral biology of Nuphar lutea subsp macrophylla. Brittonia, 29(1), 88-99 (résumé)
- Trécul, A. (1854). Études anatomiques et organogeniques sur la Victoria Regia et anatomie comparée du Nelumbium, du Nuphar et de la Victoria. Académie des sciences.
- Hill, M. O., Mountford, J. O., Roy, D. B., & Bunce, R. G. H. (1999). Ellenberg's indicator values for British plants. ECOFACT Volume 2 Technical Annex (Vol. 2). Institute of Terrestrial Ecology.
- Delbecque, E. J. P., & Suykerbuyk, R. E. M. (1988). A comparison of the periphyton of Nuphar lutea and Nymphaea alba : spatial and temporal changes in the occurrence of sessile microfauna. Archiv für Hydrobiologie, 112(4), 541-566.
- Delbecque E.J (1983) A comparison of the periphyton of Nuphar lutea and Nymphaea alba. In Periphyton of Freshwater Ecosystems (pp. 41-47). Springer Netherlands.
- Smits, A. J. M., Van Ruremonde, R., & Van der Velde, G. (1989). Seed dispersal of three nymphaeid macrophytes. Aquatic Botany, 35(2), 167-180.(résumé)
- FÉR, T., & Hroudova, Z. (2008). Detecting dispersal of Nuphar lutea in river corridors using microsatellite markers. Freshwater biology, 53(7), 1409-1422.
- Langanger, M., Jokl, S., & Musso, M. (2000). UV-reflectance in flowers of Nymphaea alba L. and Nuphar lutea (L.) Sm.(Nymphaeaceae). Aquatic Botany, 67(1), 13-21.
- Brock, T. C., De Lyon, M. J., Van Laar, E. M., & Van Loon, E. M. (1985). Field studies on the breakdown of Nuphar lutea (L.) SM.(Nymphaeaceae), and a comparison of three mathematical models for organic weight loss. Aquatic botany, 21(1), 1-22 (résumé)
- Barrat-Segretain M.H (1996), Germination and colonisation dynamics of Nuphar lutea (L.) Sm. in a former river channel. Aquatic Botany, 55(1), 31-38 (résumé)
- Kok, C. J., Van der Velde, G., & Landsbergen, K. M. (1990). Production, nutrient dynamics and initial decomposition of floating leaves of Nymphaea alba L. and Nuphar lutea (L.) Sm.(Nymphaeaceae) in alkaline and acid waters. Biogeochemistry, 11(3), 235-250 (résumé)
- Kouki, J. (1993). Herbivory modifies the production of different leaf types in the yellow water-lily, Nuphar lutea (Nymphaeceae). Functional Ecology, 21-26 (résumé).
- Elakovich, S. D., & Wooten, J. W. (1991). Allelopathic potential ofNuphar lutea (L.) Sibth. & Sm.(Nymphaeaceae). Journal of chemical ecology, 17(4), 707-714.
- Sütfeld, R., Petereit, F., & Nahrstedt, A. (1996). Resorcinol in exudates ofNuphar lutea. Journal of chemical ecology, 22(12), 2221-2231. résumé
- Outridge, P. M., & Noller, B. N. (1991). Accumulation of toxic trace elements by freshwater vascular plants. In Reviews of Environmental Contamination and Toxicology (pp. 1-63). Springer New York (résumé).
- Twining, J. R. (1993). A study of radium uptake by the water-lily Nymphaea violacea (Lehm) from contaminated sediment. Journal of environmental radioactivity, 20(3), 169-189 PDF, 22p.
- Mahon, D. C., & Mathewes, R. W. (1983). Seasonal variation in the accumulation of radionuclides of the uranium series by yellow pond-lily (Nuphar lutea). Bulletin of environmental contamination and toxicology, 30(1), 575-581 (résumé).
- Ure, A. M., & Bacon, J. R. (1978). Scandium, yttrium and the rare earth contents of water lily (Nuphar lutea). Geochimica et Cosmochimica Acta, 42(6), 651-652 (résumé)
- Aulio, K. (1980). Accumulation of copper in fluvial sediments and yellow water lilies (Nuphar lutea) at varying distances from a metal processing plant. Bulletin of environmental contamination and toxicology, 25(1), 713-717 (résumé
- Couplan, François (2009) Le régal végétal : plantes sauvages comestibles ; Editions Ellebore, 527 pages
- Hilt, S., Gross, E. M., Hupfer, M., Morscheid, H., Mählmann, J., Melzer, A., ... & Van de Weyer, K. (2006). Restoration of submerged vegetation in shallow eutrophic lakes–a guideline and state of the art in Germany. Limnologica-Ecology and Management of Inland Waters, 36(3), 155-171.
- Körner, S. (2002), Loss of submerged macrophytes in shallow lakes in North-Eastern Germany. International Review of Hydrobiology, 87(4), 375-384.
- Cybulsk J & Wróbel J.T (1989) chap V Nuphar alkaloids. The Alkaloids: Chemistry and Pharmacology V35: Chemistry and Pharmacology, 35, 215.(lien Google Livres)
- Iwanow, A., Wojtasiewicz, K., & Wróbel, J. T. (1986). Sulphoxides of thiobinupharidine thiohemiaminals from Nuphar lutea. Phytochemistry, 25(9), 2227-2231.(résumé)
- Elakovich, S. D., & Wooten, J. W. (1995). Allelopathic, herbaceous, vascular hydrophytes. Allelopathy: organisms, processes, and applications, 582, 58 (résumé).
- Kouki J (1991), The effect of the water‐lily beetle, Galerucella nymphaeae, on leaf production and leaf longevity of the yellow water‐lily, Nuphar lutea. Freshwater Biology, 26(3), 347-353. (résumé)
Voir aussi
Liens externes
- (fr) Référence Belles fleurs de France : Nuphar lutea
- (en) Référence Flora of China : Nuphar lutea
- (en) Référence Flora of Missouri : Nuphar lutea
- (en) Référence UICN : espèce Nuphar lutea (L.) Sm., 1809 (consulté le )
- (fr+en) Référence ITIS : Nuphar lutea (L.) Sm.
- (en) Référence NCBI : Nuphar lutea (taxons inclus)
- (en) Référence GRIN : espèce Nuphar lutea (L.) Sm.
- (fr) Référence Tela Botanica (France métro) : Nuphar lutea (L.) Sm.
- (fr) Référence INPN : Nuphar lutea (L.) Sm., 1809 (TAXREF)
Bibliographie
- Barrat-Segretain M.H (1996), Germination and colonisation dynamics of Nuphar lutea (L.) Sm. in a former river channel. Aquatic Botany, 55(1), 31-38 (résumé).
- Brock T.C, De Lyon M.J, Van Laar E.M & Van Loon E.M (1985), Field studies on the breakdown of Nuphar lutea (L.) SM.(Nymphaeaceae), and a comparison of three mathematical models for organic weight loss. Aquatic botany, 21(1), 1-22 (résumé)
- Cutter, E. G. (1957) Studies of morphogenesis in the Nymphaeaceae. I. Introduction: some aspects of the morphology of Nuphar lutea (L) Sm. and Nymphaea alba L. Phytomorphol, 7, 45-56.
- Kok, C. J., Van der Velde, G., & Landsbergen, K. M. (1990). Production, nutrient dynamics and initial decomposition of floating leaves of Nymphaea alba L. and Nuphar lutea (L.) Sm.(Nymphaeaceae) in alkaline and acid waters. Biogeochemistry, 11(3), 235-250 (résumé).
- Kouki, J. (1991). The effect of the water‐lily beetle, Galerucella nymphaeae, on leaf production and leaf longevity of the yellow water‐lily, Nuphar lutea. Freshwater Biology, 26(3), 347-353.
- Schröder P, Grosse, W & Woermann D (1986). Localization of thermo-osmotically active partitions in young leaves of Nuphar lutea. Journal of experimental botany, 37(10), 1450-1461 (résumé).
- Smits, A. J. M., Laan, P., Thier, R. H., & Van der Velde, G. (1990). Root aerenchyma, oxygen leakage patterns and alcoholic fermentation ability of the roots of some nymphaeid and isoetid macrophytes in relation to the sediment type of their habitat. Aquatic botany, 38(1), 3-17 (résumé).
- Smits A. . Avesaath P, Velde G. (1990). Germination requirements and seed banks of some nymphaeid macrophytes: Nymphaea alba L., Nuphar lutea (L.) Sm. and Nymphoides peltata (Gmel.) O. Kuntze. Freshwater Biology, 24(2), 315-326 (résumé).
- Smits A.J.M, Van Ruremonde R & Van der Velde G (1989), Seed dispersal of three nymphaeid macrophytes. Aquatic Botany, 35(2), 167-180.
- Smits A.J.M, De Lyon, M.J H, Van der Velde G, Steentjes P.L.M & Roelofs J.G.M (1988), Distribution of three nymphaeid macrophytes (Nymphaea alba L., Nuphar lutea (L.) Sm. and Nymphoides peltata (Gmel.) O. Kuntze) in relation to alkalinity and uptake of inorganic carbon. Aquatic Botany, 32(1), 45-62 (http://www.sciencedirect.com/science/article/pii/0304377088900873 résumé]).
- Sütfeld, R., Petereit, F., & Nahrstedt, A. (1996). Resorcinol in exudates ofNuphar lutea. Journal of chemical ecology, 22(12), 2221-2231.
- Trécul, A. (1845). Recherches sur la structure et le développement du Nuphar lutea. publisher not identified.
- Winter, A. N., & Shamrov, I. I. (1991). The development of the ovule and embryo sac in Nuphar lutea (Nymphaeaceae). Botanicheskii Zhurnal, 76, 378-390.