Mandipropamide
Le mandipropamide est un composé chimique de formule brute C23H22ClNO4 faisant partie de la famille des fongicides CAA (Carboxylic Acid Amide). Il est principalement utilisé en agrochimie. Le mandipropamide a été développé pour lutter contre différentes espèces d’oomycètes, qui sont à l’origine de différents mildious : le Phytophtora infestans (mildiou de la pomme de terre et de la tomate) et le Plasmopara viticola (mildiou de la vigne).
| Mandipropamide[1] | ||
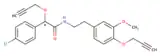
| ||
 | ||
| Représentations du mandipropamide | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 2-(4-chlorophenyl)-N-[2-(3-methoxy-4-prop-2-ynoxyphenyl)ethyl]-2-prop-2-ynoxyacetamide | |
| No CAS | ||
| No ECHA | 100.130.842 | |
| No CE | 609-434-0 | |
| Apparence | poudre beige clair | |
| Propriétés chimiques | ||
| Formule | C23H22ClNO4 | |
| Masse molaire | 411,88 g mol−1 | |
| Propriétés physiques | ||
| T° fusion | 96,4 à 97,3 °C | |
| T° ébullition | 200 °C | |
| Solubilité | 4,2 g·L-1 dans l'eau à 25 °C. | |
| Masse volumique | 1,24 g·cm-3 (22 °C) | |
| Pression de vapeur saturante | 20 °C, 25 °C et 50 °C : < 9,4×10-7 Pa | |
| Précautions | ||
| SGH | ||
 Danger |
||
| Écotoxicologie | ||
| DL50 | > 5 000 mg/kg (rat, oral), > 1 000 mg/kg de terre (ver de terre), > 200 μg/abeille (abeille, oral) | |
| LogP | 3.2 | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Il est commercialisé depuis 2005[2] sous les noms de marque Revus et Pergado, pour lutter respectivement contre le mildiou des cultures de pommes de terre et des cultures de vignes. On le retrouve sous forme de mélange racémique, l’emploi d’un énantiomère ou de l’autre ne changeant rien à son utilisation et ses effets.
Découverte
À la fin du XIXe siècle, les réactions multicomposants ont été découvertes et ont été utilisées dans la synthèse de nombreux fongicides, tel que le mandipropamide, obtenu par le phénomène de dérivatisation[3].
Dans les années 1990, les laboratoires de recherches BASF et Bayer, anciennement American Cyanamid et Agrevo, ont publié des travaux sur des antifongiques. Leurs recherches sont quelque peu différentes mais ont toutes deux mené à la découverte du mandipropamide[2].
La vanilline peut servir comme molécule de départ pour la synthèse du mandipropamide. Celle-ci a été amenée à réagir avec différents composés, jusqu’à obtention d’une molécule de type formamide, possédant un groupe amide et un groupe propargyl[2]. Ces groupes augmentent l’efficacité fongicide du composé. De plus, lorsqu’il est substitué, le groupement phényle a également été vu comme un avantage, car celui-ci apporte de bon résultats biologiques. Les scientifiques ont alors cherché à améliorer le formamide en procédant à un ajout de phényle substitué, suivi d’une propargylation[3].
Ceci leur a finalement permis d’obtenir le mandipropamide, qui se révèle être efficace face à une majorité de maladies dues aux oomycètes, telles que Phytophtora infestans, Plasmopara viticola ou encore Pseudoperonospora cubensis[3].
Synthèse
La synthèse du mandipropamide peut se faire par réaction multicomposants (MCR) qui fait intervenir la réaction de Passerini modifiée par Seebach[2] Sur la figure 1, les 4 étapes non-développées de cette réaction représentent le passage de la vanilline (1) au N‐{2‐[3‐methoxy‐4‐(prop‐2‐yn‐1‐ yloxy)phenyl]ethyl}formamide (2). Cette dernière molécule est ensuite obtenue par une réaction de Henry suivie d’une réduction, d’une formylation ainsi que d’une propargylation[4]. Le formamide (2) est déshydraté par le triphosgène pour former l’isonitrile en présence de 4-chlorobenzaldéhyde et de chlorure de titane, ce qui permet la formation de l’hydroxyamide (3). Celui-ci est alkylé par le bromure de propargyle via une catalyse par transfert de phase qui aboutit à la formation du mandipropamide (4)[2].
Néanmoins, la réaction de Passerini modifiée n’est pas applicable à l’échelle industrielle[2]. Bien qu’elle ait facilité la découverte du mandipropamide, cette voie de synthèse nécessite l’emploi de chlorure de titane qui est une substance corrosive, ainsi que de dichlorométhane comme solvant, considéré toxique pour l’environnement. Celle-ci engendrera la formation de produits toxiques, tels que des oxychlorures de titane solides, et créera une accumulation de déchets qu’il faudra éliminer par la suite. Pour y remédier, différentes améliorations de la réaction de Passerini ont été effectuées au cours des années. Autrement dit, ce sont des synthèses alternatives à cette réaction, pour la production industrielle. L’une d’elles est à privilégier, il s’agit de la plus récente à ce jour. Celle-ci nécessite notamment l’utilisation de chlorobenzène, qui est un solvant bien moins toxique pour l’environnement que ne l’est le dichlorométhane. De plus, aucune manipulation supplémentaire, telles que des extractions ou des purifications par chromatographie, sont à réaliser[2]. Toutefois, cette voie de synthèse ayant été créée récemment, nous manquons d'informations à son sujet pour le moment.
Mode d'action
L’action d’un composé phytosanitaire est garantie par sa lipophilie et sa solubilité dans l’eau, lui permettant une bonne absorption par les feuilles des végétaux concernés. La lipophilie est caractérisée par le coefficient de partage P. Pour assurer la pénétration du composé au sein de la feuille, ce dernier doit avoir un log(P) environ compris entre -2 et 3[2]. En ce qui concerne la solubilité dans l’eau, plus celle- ci est élevée, et plus le composé est absorbé par les racines (risquant d’être davantage perdu dans le sol). Le mandipropamide remplit les conditions nécessaires à sa bonne propagation dans les végétaux, avec log(P)=3,2[1] et une solubilité dans l’eau plutôt faible (4,2 mg/L)[1].
Une fois propagé au sein de la plante, le mandipropamide ne pénètre pas directement dans la cellule des agents pathogènes, mais joue un rôle d’inhibiteur dans la synthèse de la cellulose des oomycètes au niveau de leur paroi cellulaire[5].
Impacts
Homme
Des études ont montré que le mandipropamide ne présente aucun effet néfaste sur l’Homme[6]. En effet, dans la majorité des cas, le composé est présent dans les aliments uniquement sous forme de traces. Par exemple, les taux résiduels du mandipropamide sur les pomme de terre sur une période de 3 à 6 jours après pulvérisation ne dépassent pas 0.01 mg/kg[2], alors que la dose maximale acceptée est de 0.03 mg/kg[2]. Le consommateur n’est donc (quasiment) pas exposé à la substance.
Les études ont également montré que le taux de mandipropamide présent dans le raisin passe sous le seuil de détection au bout de 21 jours[2], la récolte se faisant au bout de 28 jours[2]. Encore une fois, le consommateur n’est pas exposé au produit. Aucune étude n’a été menée sur le suivi du taux de mandipropamide présent dans les récoltes de tomates. De plus, la pulvérisation du produit sur les cultures ne présente aucun danger pour le manipulateur ou les habitants voisins. Selon les estimations, la pulvérisation du produit par tracteur avec cabine n’expose le manipulateur qu’à 1%[2] de la quantité quotidienne maximale, une valeur considérée comme suffisamment faible.
Environnement
Le mandipropamide peut présenter des effets néfastes sur certains mammifères tels que les rats, provoquant une diminution du poids corporel des progénitures[6]. De plus, le mandipropamide peut être relargué dans l’environnement par dissolution dans les eaux de pluie, et se propager dans les rivières, lacs et réserves d’eau souterraine. Cependant, sa solubilité dans l’eau étant relativement faible, il se dissout dans l’eau à faible concentration[2]. Ainsi, le mandipropamide peut représenter un danger pour les zones aquatiques s’il est utilisé de manière excessive (ce pourquoi il est classé GHS09), mais des études ont prouvé qu’il ne présentait aucune toxicité aiguë pour l’environnement, lorsqu’il est utilisé dans le respect des doses appropriées[6].
Dégradation de la molécule
Le mandipropamide est principalement dégradé par photolyse et hydrolyse, mais aussi par biotransformation. Sa demi-vie dans le sol est comprise entre 1,3 et 5,7 semaines[1]. Les produits de dégradation du mandipropamide sont principalement des acides et du phénylpyrazole.
Réaction de photolyse
La photolyse du mandipropamide en solution aqueuse peut se dérouler selon la réaction photochimique suivante :
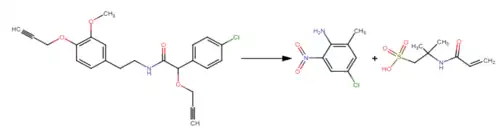
La photolyse du mandipropamide peut se déclencher lorsque la substance est exposée à la lumière du soleil, les produits de dégradation dépendent de la durée et de l’intensité de l’exposition.
Réaction d'hydrolyse
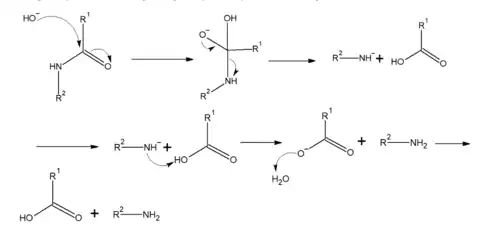
Son hydrolyse peut se réaliser en milieu acide ou basique. L’hydrolyse acide implique l’attaque de l’atome d’azote de la fonction amide via le doublet non liant pour capter un proton (réaction acide/base), afin d'accroître l’électrophilicité du carbone. L’eau joue ensuite le rôle de nucléophile en attaquant le carbone de l’amide pour former un acide carboxylique et une amine. (figure 3)
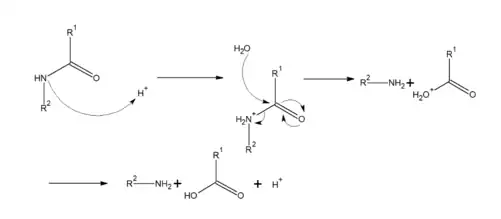
L’hydrolyse basique est similaire à celle de l’hydrolyse acide, la réaction étant catalysée par des ions hydroxydes plutôt que des ions hydronium (figure 4).
Alternatives au mandipropamide
Malgré sa forte efficacité, le mandipropamide n’est pas infaillible. En effet, certains mutants naturels du P. Viticola se sont développés au cours du temps, et résistent au mandipropamide[5]. Ainsi, il est intéressant de noter qu’il existe de nombreuses alternatives à ce fongicide. En effet, plusieurs molécules ayant un caractère anti-oomycètes sont développées et commercialisées.
En voici quelques exemples :
- Amides dérivés de l’acide mandélique et analogues[8]
- Imidazole et oxazolidinedione[9]
- Benzamide[10]
- Valinamide
- Cyanoimidazole[11]
- Thiazole carboxamide
- Pyrimidylamine
Les avantages de ces alternatives varient en fonction de la molécule spécifique, en général ils incluent une meilleure efficacité, une plus grande sélectivité pour certaines cultures, une faible toxicité, ou une réduction de l’impact environnemental.
Notes et références
- (en) Annex 1 - Background document to the Opinion proposing harmonised classification and labelling at EU level of mandipropamid - Committee for Risk Assessment (RAC) - European Chemicals Agency (ECHA), .
- Erb William et Abermil Nacim, « Le Mandipropamide Contre Les Oomycètes: L’apport Des Réactions ; multicomposants à La Phytochimie », L’Actualité Chimique, Le Journal de La SCF, Société Chimique de France (SCF), no 405, -, p. 16.
- (en) Lamberth Clemens, Jeanguenat Andre, Cederbaum Fredrik, De Mesmaeker Alain, Zeller Martin, Kempf Hans-Joachim, Zeun Ronald, « Multicomponent reactions in fungicide research: The discovery of mandipropamid », Bioorganic & Medicinal Chemistry, vol. 16, no 3, , p. 1531-1545.
- (en) Banfi Luca, Basso Andrea, Lambruschini Chiara, Moni Lisa, Riva Renata,, « The 100 facets of the Passerini reaction », Chemical Science, vol. 12, no 47, , p. 15445-15472.
- (en) Mathias Blum, Martine Boehler, Eva Randall et Vanessa Young, « Mandipropamid targets the cellulose synthase-like PiCesA3 to inhibit cell wall biosynthesis in the oomycete plant pathogen, Phytophthora infestans », Molecular Plant Pathology, vol. 11, no 2, , p. 227–243 (DOI 10.1111/j.1364-3703.2009.00604.x, lire en ligne, consulté le ).
- (en) « Conclusion on the peer review of the pesticide risk assessment of the active substance mandipropamid | EFSA », sur www.efsa.europa.eu (DOI 10.2903/j.efsa.2012.2935, consulté le ).
- Li, J., Han, J., Lan, T. et al. Enantioselective hydrolysis and photolysis of mandipropamid in different aquatic environments — evaluation of influencing factors. Environ Sci Pollut Res 29, 60244–60258 (2022). https://doi.org/10.1007/s11356-022-20202-4
- (en) D.K Dey, « Mandipropamid, an excellent oomycete fungicide with resistance risk low in crops », Pest Management Science, vol. 74, no 7, , p. 1477-1485.
- (en) Y.Wang, « Discovery of Imidazole Derivatives as Fungicides : A review », Molecules, vol. 24, no 8, , p. 1581.
- (en) « Benzamide fungicides : Mechanisms of action and resistance development », Plant Pathology, J.O.T. Ferreira, vol. 70, no 1, , p. 10-23.
- (en) J.M. Barbosa, « New cyanoimidazole derivatives as oomycete fungicides: Synthesis, in vitro and in vivo antifungal activity, and docking study », Bioorganic and Medicinal Chemistry, vol. 28, no 5, .
.jpg.webp)