Hétérométrie (biologie)
Une hétérométrie est une modification de l'expression d'un gène ou de son patron d'expression, qui entraîne une différence quantitative chez l'individu, c'est-à-dire au niveau du phénome. C’est le résultat d’une mutation (biais intrinsèque) au niveau du génome qui va entrainer une modification au niveau du phénome. Il s'agit donc d'une modification de la morphologie d’un individu au cours de l'évolution liée à une mutation des gènes du développement, et se retrouve donc soit au niveau moléculaire ou au niveau morphologique[1].
Cela s’exprime par la modification de la taille, du nombre ou de la concentration d'un élément qui peut se comparer ensuite entre différentes lignées ou entre les différentes parties d’un même organisme. L’augmentation ou la diminution de la taille d’un organe par rapport au reste du corps représente un exemple d’hétérométrie. Souvent, l’hétérométrie sera liée de façon plus ou moins directe avec d’autres types de modifications comme l’hétérochronie ou l’hétérotopie, car si un organe augmente en taille, alors il occupera plus d'espace et peut également prendre plus de temps pour se développer.
C'est un terme relativement récent contrairement à hétérochronie et hétérotopie, et il est relativement difficile de trouver des ouvrages traitant de ce sujet précisément. Cependant, des exemples de l'hétérométrie sont recensés dans de nombreuses études parlant d'évolution, simplement le terme ne fût pas encore utilisé.
Gène Manx
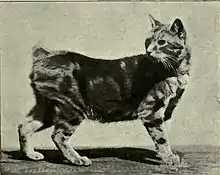
Chez le chat
Les chordés se distinguent des autres animaux par une corde nerveuse dorsale creuse et une notochorde, qui définissent l'axe d’une symétrie bilatérale. Ces caractéristiques du plan du corps des chordés se développent pendant l'embryogenèse et sont contrôlés par l’activité des différentes régions organisatrices[2].
Le gène Manx est nécessaire pour le développement de la queue et a été étudié dans le cas d’anomalie morphologique comme dans le cas du chat de race Manx, qui a la particularité de naître sans queue (agénésie caudale), ou avec une queue extrêmement courte. L’anomalie est due à un mutant, gène autosomique dominant M qui provoque un développement anormal du coccyx et des vertèbres sacrées. Tous les chats Manx sont hétérozygotes pour le gène Manx (c’est-à-dire M/m), ce qui signifie qu'ils ont un gène mutant de M et un gène normal m chacun hérité d'un parent. Le gène M est une forme mutante du gène normal m et est dominant. Les homozygotes (porteur des deux gènes responsable de l'absence de queue) sont si affectés qu’ils meurent au cours du développement précoce du fœtus dans l’utérus, donc le gène Manx est décrit comme étant un gène létal[3]. L’expression variable du gène mutant M dans les individus hétérozygotes (M/m) est due à l'action d'autres gènes qui modulent ses effets. Ces gènes modificateurs sont actuellement non identifiés. Robinson[4] suggère que la variation de l'expression est seulement en partie d'origine génétique et que le reste serait lié à d'autres facteurs, sans doute, des facteurs environnementaux. L'élevage du Manx est délicat, d'une part parce qu'une chatte donne naissance à peu de chatons, et d'autre part par l'aspect génétique car un Manx homozygote n'est pas viable puisque la moelle épinière ne se développe pas complètement. Tous ces chatons meurent dans l'utérus et ceux qui naissent sont donc forcément hétérozygote.
Lors d'une étude, Deforest et Basrur[5] ont démontré plusieurs anomalies dues au degré d'agénésie caudale. Beaucoup de chats examinés au cours de la présente étude ont montré des preuves des problèmes cliniques et développementaux, qui sont tous censés être associés à cette malformation. Bien que l'absence de queue soit la modification la plus visible chez le chat Manx, des autopsies effectuées au cours de cette étude indiquent que la moelle épinière est hautement anormale et que ces animaux sont atteints de problèmes comme le spina bifida, l'incontinence, la perte sensorielle périnéale et la démarche postérieure anormale. Dans ces cas, la moelle épinière prend fin prématurément avec une absence de certains nerfs rachidiens qui fournissent une innervation au niveau du côlon, de la vessie, des membres postérieurs et de la région du périnée.
Le mécanisme le plus simple qui puisse être envisagé est celui d’un avantage sélectif de l’hétérozygote dû à une intervention humaine : les habitants de l’île de Man auraient une préférence pour les chats sans queue[6]. Cependant, dans un plus récent travail, Adalsteinsson[7] suggère une autre hypothèse, fondée sur l’analyse des distinctions observées parmi les progénitures des trois catégories de couples M/m x M/m. Deux mécanismes sont proposés : une sélection gamétique agissant sur les spermatozoïdes et une dérive méiotique lors de la gamétogenèse femelle (pour un ovule formé par une femelle M/m, la probabilité de recevoir l’allèle M ne serait pas obligatoirement 1/2, mais dépendrait du génotype du spermatozoïde fécondant, dont la pénétration a lieu alors que la méiose n’est pas encore terminée). Il est bien connu que l’absence (ou plutôt la très forte réduction) de la queue est accompagnée d’anomalies graves : il ne serait pas étonnant que ces anomalies entraînent une faible compétitivité des animaux M/m vis-à-vis des m/m. Ce défaut de compétitivité naturelle pourrait être compensé par une intervention humaine visant à conserver préférentiellement un phénotype exceptionnel. Un tel mécanisme ne pourrait être mis en évidence que par une étude précise des aptitudes des génotypes M/m et m/m (comparaison des espérances de vie par exemple) ainsi que du comportement des propriétaires de chats de l’Île de Man.
À savoir que cette anomalie est également visible chez certains chiens, et que comme pour le chat, l'homozygote est létal en raison de défauts de développement graves[8]. Cependant, les terriers de Boston et les bulldogs anglais n'ont pas de queue ou ont des queues très courtes et crépues, indiquant que le phénotype est fixe et est devenu une caractéristique de la race. Les propriétaires de chien à la queue courte chien ont besoin d'un certificat vétérinaire pour prouver que la queue courte est naturelle s'ils veulent participer à des expositions canines. Dans les races porteuses de la mutation, les inspections vétérinaires peuvent maintenant être remplacées par un simple test génétique.
Chez l'ascidie
_on_Siphonogorgia_godeffroyi_(Soft_tree_coral).jpg.webp)
Le gène Manx a également été étudié chez l'ascidie, un animal marin dont la larve ressemble à un petit têtard de grenouille, composé d'une grosse « tête » et d'une queue nageuse contenant un tube nerveux et une corde dorsale. La corde et le tube neural, caractéristique des cordés, disparaissent quand l'animal se fixe sur son substrat à l'âge adulte. La présence et l'importance du gène Manx a été mis en lumière par différentes études dont celle publiée par une équipe de chercheurs en 1999[2], qui montre bien le rôle de ce gène dans le développement de la queue et d'autres caractéristiques des chordés. Le gène bobcat est également cité comme essentiel à ce développement durant l’embryogenèse. La découverte du locus du gène Manx-bobcat, dans lequel au moins deux gènes sont nécessaires pour le développement de caractéristiques des chordés, ouvre la possibilité que des modifications de ce complexe de gènes peuvent être responsables des variations de l'évolution rapide de développement, tels que ceux qui peuvent surgir dans les ascidies sans queue. Ainsi, il sera important de déterminer l'organisation du locus du gène Manx-bobcat dans les espèces sans queue.
Autres types d'hétérométrie
Chez l’homme
L’augmentation de la taille du cerveau humain est également une marque d’hétérométrie unidirectionnelle. En comparaison avec le cerveau d’un chimpanzé, le cerveau de l’homme est plus grand alors que leur dernier ancêtre commun avait plutôt un cerveau de la taille de celui du chimpanzé. Cela implique donc une augmentation de la taille du cerveau au cours du temps et de l’évolution[1].
Les hypothèses à ce sujet seraient les deux suivantes :
- Un plus grand cerveau permettrait l’utilisation d’outils ou d’une langue parlée et augmenterait la survie potentielle.
- La sélection sexuelle aurait entraîné une tendance du choix pour des partenaires ayant des caractéristiques associées avec une taille de cerveau plus grande, et de ce fait une plus grande reproduction de ceux-là.
Dans le cas d’une hétérométrie décroissante, et donc d'une disparition majeure ou totale d’une partie, on parle là de remodelage du patron de développement (repatterning). Cela peut par exemple concerner des structures vestigiales dans l’organisme. Chez la baleine par exemple, on peut trouver des os de pattes vestigiales dans le squelette. Ce sont là les marques d'anciennes pattes de leurs ancêtres terrestres. Chez l'homme également, il existe des structures de ce type, par exemple le coccyx qui serait un vestige d'une queue passée, ou l'appendice servant dans la digestion d'une diète différente de celle que nous avons actuellement. Ce sont là des considérations importantes pour la théorie de l'évolution.
Chez le papillon

Lorsque l'on observe un changement dans deux directions, surtout dans le cas d’une longue période de temps d’évolution, il s'agit alors d’hétérométrie bidirectionnelle. En observant les variations des ocelles sur les ailes du papillon du genre Bicyclus, on remarque un polyphénisme saisonnier dans la taille et le nombre des motifs en forme d’œil. Un gène impliqué dans cette formation d'ocelle est le gène distall-less[9], qui fut d'abord découvert pour son rôle dans la formation des pattes chez la mouche Drosophile.
Les lépidoptères, comme les diptères, sont des insectes holométaboles chez lesquels l'adulte se développe à partir d'une série de disques imaginaux intégrés dans la larve. Les cellules de ces disques prolifèrent au cours de la métamorphose afin de donner naissance aux structures adultes.
Des régions d'expression de distall-less peuvent être trouvées dans les disques de développement tardif larvaire des ailes, et plus ces disques sont grands, plus les ocelles le seront également. Il est donc possible de relier une expression différentielle de ce gène dans les disques imaginaux à une taille des ailes et un nombre de motifs différentiels chez l’adulte.
Bien que cela soit plutôt lié à la plasticité phénotypique, il y a également une composante héréditaire de ces motifs[1].
Chez les oiseaux
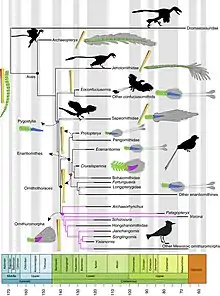
La grande majorité des dinosaures Théropodes (Tétrapodes bipèdes) non-aviaires ne possédaient pas une queue courte, mais une queue longue comme on en observe chez les Reptiles contemporains. En effet, même Archeopteryx, considéré comme le représentant le plus ancien de la classe Aves et du sous-groupe Avialae, était muni d’une longue queue composée de près d’une vingtaine de vertèbres. C’est d’ailleurs au sein d’Avialae que Sapeornis, le premier oiseau avec une queue raccourcie de 6-7 vertèbres en plus d’avoir un pygostyle (os du croupion) plus long que chez d’autres oiseaux plus primitifs, est apparu[10]. Ces deux caractéristiques morphologiques ont eu l’effet d’un catalyseur sur la diversification des oiseaux en fournissant des avantages pour leur survie, notamment grâce au perfectionnement du vol, en plus de diversifier les mécanismes de sélection sexuelle. Effectivement, le pygostyle serait potentiellement apparu en même temps que les plumes de queue (rectrices) en forme d’éventail permettant la formation de toutes sortes de plumages servant lors des parades. Des changements musculaires tels que la perte du muscle caudofémoral ont accompagné la réduction du nombre de vertèbres[11]. Il a précédemment été démontré par Gao & al. (2008) que c’est le genre Zhongornis qui, par sa morphologie, correspond le plus à un intermédiaire entre Archeopteryx et les oiseaux actuels[12].
Ces modifications qui se sont produites plutôt subitement durant l’histoire évolutive du clade sont essentiellement le résultat d’un remodelage des patrons développementaux de nature hétérométrique (quantitative) se manifestant lors de la somitogenèse de l’embryon aviaire. En effet, lors de l’élongation normale de la queue d’un embryon Vertébré, les paires de somites caudales se forment à partir du mésoderme présomitique, après l’étape de la gastrulation, dans le bourgeon de la queue par la rencontre de gradients de protéines extracellulaires : celui de Wnt/Fgf ainsi que celui de l’acide rétinoïque. De plus, le gène Notch détermine les frontières de chaque somite alors que les gènes Hox leur fournissent une identité régionale (ex : crâniale, caudale, etc.). Plusieurs autres cascades de signalisation et d’interactions sont impliquées dans l’élongation ou la terminaison de la queue, telle que celle impliquant Noggin et sa régulation de Bmps et Shh[10].
Le développement de la queue du poulet a particulièrement été étudié par des modifications des taux d’acides rétinoïques dans le bourgeon caudal ou par des régulations de l’expression du gène Hox13a. Cependant, il est à noter que l’électrophorèse, les microinjections et l’insertion de matrice dans le génome chez un embryon sont d’autres manipulations réalisées dans le but de réguler les protéines de ce-dernier. Dans une étude, Rashid & al. (2014) ont tenté de mettre en lumière les mutations conservées chez les oiseaux actuels (Aves) qui seraient à l’origine ou auraient participé à la réduction de la taille de la queue des oiseaux primitifs ainsi qu’à la formation du pygostyle. Cette transition regroupe des changements développementaux aux niveaux moléculaire, musculaire, squelettique, et nerveux. De manière générale, l’étude avait comme but de démontrer si l’apparition dans les registres fossiles d’oiseaux munis d’une queue courte correspond au résultat d’une combinaison d’effets pléiotropiques causés par différents épisodes de mutations ou d’une seule mutation de grande importance[10].
Pour ce faire, ils ont généré une banque regroupant des informations génétiques sur des souris ayant une queue mutante à partir de données théoriques déjà acquises sur le développement des queues de Vertébrés. Plusieurs corrélations génétiques ont été paramétrées par les chercheurs afin de bien comparer les différences connues entre les squelettes des oiseaux modernes (Aves), des oiseaux primitifs ainsi que des Théropodes. Comme plusieurs gènes mutés ou knockout (inactivation) par transgénèse induisent une plasticité phénotypique à différents niveaux de la queue chez cet animal, ils ont pu faire certaines observations. Les gènes compris dans cette banque étaient tous associés à l’extension axiale du corps d’un organisme et avaient donc des rôles dans différents stades du développement embryonnaire, soit lors de la somitogenèse, de la neurulation ou même de l’angiogenèse. Durant cette étude, l’effet régulateur de certains composés était incorporé dans leur analyse[10]. Par exemple, les conséquences d’une exposition prolongée à l’acide rétinoïque par la queue d’un embryon d’oiseau sont bien documentées dans la littérature. À forte exposition, cette molécule tératogène peut causer de graves malformations au niveau du squelette et du système nerveux basal. Parmi celles-ci on compte notamment la formation d’un second tube neural accessoire[13]. Par contre, une exposition modérée et contrôlée à cet acide est requise par les somites pour leur maturation afin que la somitogenèse se poursuive normalement.
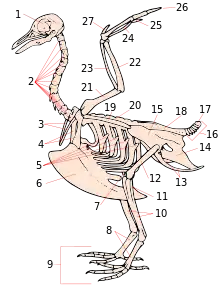
Globalement, les profils générés témoignaient de la fragilité au niveau moléculaire du processus d’élongation de la queue en raison du nombre élevé de mutations différentes entraînant son interruption à divers degrés. D’abord, les souris de la liste qui avaient les gènes Hoxb13 et Slx4 knockout possédaient des queues un peu plus longues que celles du type sauvage. En fait, "sur les 20 (de 23) mutations étudiées par le passé, 10 impliquent les voies de signalisation Notch ou Notch/Wnt". Pour le reste, ce sont des mutations qui touchent principalement les voies Bmp/Shh et Wnt seul. La plupart des mutations affectant Notch concernaient des gènes directement impliqués dans la différenciation et la segmentation des somites[10].
Chez les oiseaux, les seules mutations apparues spontanément dont les porteurs sont dépourvus de queues et présentent davantage de fusions des vertèbres caudales sont dans les gènes Irx1 et Irx2 (Iroquois). On retrouve naturellement chez les poulets Araucana ce phénotype empêchant la formation de leur pygostyle en raison d’une perturbation générée dans la cascade de signalisation de Notch, Wnt et Bmp/Shh[10].
L’évolution morphologique caudale des oiseaux est un bon exemple d’hétérométrie puisque les changements sont causés par des modifications des concentrations de certaines molécules ou du taux d’expression des gènes impliqués. On pourrait également faire un lien avec la perte de muscles, d’os et de vertèbres. En dépit du fait que l’étude concernée n’ait pas pu déterminer le nombre et l’identité des mutations de gènes pléiotropiques responsables du raccourcissement de la portion caudale du squelette des oiseaux primitifs, les résultats obtenus laissent fortement croire qu’il n’y en aurait eu qu’une seule. La grande majorité de souris avec des queues mutantes listées dans l’étude avaient des fusions des vertèbres caudales en raison d’une seule mutation. Dans la plupart des cas, les mutants avaient également des fusions vertébrales plus antérieures ou même des fusions costales. De plus, cette-dernière serait supposément apparue dans le groupe de dinosaures Paraves lui-même apparu vers la fin du Jurassique. La persistance de ces caractères squelettiques jusqu’aux oiseaux modernes témoigne des avantages qu’ils confèrent. Ils furent probablement fixés par les premières populations les possédant. C’est finalement la précarité des processus développementaux de la queue qui est le facteur majeur de cette transition et la mutation à l’origine de ceux-ci a dû générer d’importants débalancements dans les cascades de signalisation nécessaire à une élongation normale de la queue des Théropodes. Fondamentalement, leur queue est tronquée lorsqu’il n’y a plus d’équilibre entre Wnt3a, Fgf8 et l’acide rétinoïque ainsi que Noggin, Shh et Bmps.
Hétérométrie génétique
La protéine Engrailed est un facteur de transcription qui a pour rôle de conférer une identité spécifique à chaque partie du corps de la Drosophile que ce soit durant le stade embryonnaire, larvaire, ou adulte. Cette protéine a aussi un rôle très important dans la neurogenèse. Dans l'étude de trois groupes de balanes (sous-embranchement des crustacés), l'accent a été mis durant leur stade de développement passant par la larve nauplie[14]. Lors de ce stade, on note de petites bandes d'expression abdominales du gène de segmentation engrailed, ce qui révèle la présence d'un abdomen vestigial chez cette espèce. La réduction de la taille de l'abdomen ou son absence totale chez l'adulte n'a pas encore de réponse fixe, juste une hypothèse adaptative qui suggère que cette sélection s'est effectuée à la suite du mode de vie sessile (fixés sur le substrat), avec enfouissement, ou parasitaire des balanes et que l’abdomen était une structure non nécessaire pour ce mode de vie.
Notion de compensation hétérométrique
Parfois lorsqu’un caractère se modifie, un autre lui répond par la même action et compense la perte occasionnée par ce changement. Par exemple, dans le cas de l’espèce Astyanax mexicanus, qui est un poisson vivant dans des grottes sombres, les yeux subissent une réduction si forte qu’ils sont souvent perdus. La raison de la perte de ce caractère n’est pas encore élucidée, mais il existe plusieurs hypothèses à cela, par exemple une sélection négative si l’organe n’apporte aucun bénéfice, et au contraire serait même problématique car sujet à des maladies. En effet, dans le cas d'un organe pouvant être négatif à la survie de l'espèce, l'organisme s'arrange pour évoluer de façon à l'éliminer et donnera avantage à autre chose. Afin de compenser cette perte, on assiste donc à une augmentation de la présence des papilles gustatives, une mâchoire plus grande, ainsi qu'une augmentation du nombre de dents[1]. Ces avantages sont clairement liés à une compensation de la perte d’une aptitude afin d'améliorer la survie de cette espèce.
Articles connexes
Notes et références
- (en) Evolution: A Developmental Approach, Wallace Arthur. (2011)
- (en) A multigene locus containing the Manx and bobcat genes is required for development of chordate features in the ascidian tadpole larva. Billie J. Swalla, Margaret A. Just, Erica L. Pederson, et William R. Jeffery. (1999).
- (en) Genetic welfare problems of companion animals, Manx Syndrome, Veterinary genetics and reproductive physiology. A textbook for veterinary nurses and technicians. Butterworth Heinemann Long S (2006) : Londres (page 18).
- (en) Expressivity of the Manx Gene in Cats'. Journal of Heredity'. 84, 170-172. Robinson R (1993)
- (en) « Malformations and the Manx Syndrome in Cats » (consulté le ). M. E. DeForest and P. K. Basrur, The Canadian Veterinary Journal, 1979
- (en) Mutant allele frequencies in domestic cats of the Isle of Man. Carnivore Genetique Newsletter, 3, 388-407. Todd N.B., Garrad L.S., Blumenberg B., 1979.
- (en) Establishment of equilibrium for the dominant lethal gene for Manx taillessness in Cats. Theorie application Genetic, 58, 49-53.Adalsteinsson S., 1980.
- (en) Indrebø A, Langeland M, Juul HM, Skogmo HK, Rengmark AH, Lingaas F., A study of inherited short tail and taillessness in Pembroke Welsh Corgi. J Small Animal Practice, .
- (en) « Distal-less encodes a homoeodomain protein required for limb development in Drosophila, Nature Publishing Group Nature 338, 432 - 434 (30 March 1989) » (consulté le ).
- Dana J Rashid, Susan C Chapman, Hans CE Larsson et Chris L Organ, « From dinosaurs to birds: a tail of evolution », EvoDevo, vol. 5, no 1, , p. 25 (ISSN 2041-9139, DOI 10.1186/2041-9139-5-25, lire en ligne, consulté le )
- David R. Schwimmer et Jeffrey J. Thomason, « Functional Morphology in Vertebrate Paleontology », PALAIOS, vol. 13, no 4, , p. 402 (ISSN 0883-1351, DOI 10.2307/3515329, lire en ligne, consulté le )
- CHUNLING GAO, LUIS M. CHIAPPE, QINJING MENG et JINGMAI K. OCONNOR, « A NEW BASAL LINEAGE OF EARLY CRETACEOUS BIRDS FROM CHINA AND ITS IMPLICATIONS ON THE EVOLUTION OF THE AVIAN TAIL », Palaeontology, vol. 51, no 4, , p. 775–791 (ISSN 0031-0239 et 1475-4983, DOI 10.1111/j.1475-4983.2008.00793.x, lire en ligne, consulté le )
- C. May Griffith et Michael J. Wiley, « Effects of retinoic acid on chick tail bud development », Teratology, vol. 43, no 3, , p. 217–224 (ISSN 0040-3709 et 1096-9926, DOI 10.1002/tera.1420430305, lire en ligne, consulté le )
- (en) « Nauplie », sur aquaportail.com (consulté le ).