Hétérochronie
L’hétérochronie est la modification de la durée et de la vitesse du développement d’un organisme par rapport à celles de ses ancêtres[1]. Ces modifications sont la conséquence de la mutation de certains gènes du développement[2] qui contrôlent le développement et la mise en place des organes. Ainsi, de grands changements au point de vue macroscopique peuvent survenir dans l’organisme grâce à l’hétérochronie sans pour autant qu’il y ait de modifications génétiques importantes[1] .
L’hétérochronie a un rôle important dans l’évolution. Cependant, les changements hétérochroniques qui se produisent dans le développement arrivent le plus souvent dans les stades tardifs du développement, puisque les stades précoces sont plus basales et un changement hétérochronique sur ceux-ci serait surement létal ou du moins réduirait de beaucoup la valeur adaptative[3].
Étymologie
Le terme hétérochronie vient du grec ancien : ἕτερος (héteros, « autre ») et de χρόνος (khrónos, « temps »). Cela signifie littéralement : « temps autre ».
Types d’hétérochronie
Plusieurs modèles d’hétérochronie ont été proposés dans divers ouvrages traitant du sujet. Les six types principaux d’hétérochronie (divisés en deux catégories) sont bien décrits dans le modèle de McNamara (inspiré de Gould)[4].
Tout d’abord, il existe deux catégories qui nous informent sur l’effet de l’hétérochronie: les changements qui impliquent un sous-développement par rapport à l’ancêtre sont regroupés dans la catégorie de la pédomorphie et ceux qui impliquent un surdéveloppement dans la catégorie de la péramorphie. Chacune de ces deux catégories peut ensuite être divisée en trois catégories qui nous informent sur la nature de l’hétérochronie. Soit l’hétérochronie provient d’un changement de vitesse dans le développement, d’un déplacement du début du développement ou d’un déplacement de la fin du développement.
| Nature ⇓ / effet ⇒ | Pédomorphie (sous-développement) |
Péramorphie (surdéveloppement) |
|---|---|---|
| Vitesse du développement |
Néoténie (ralentissement) | Accélération |
| Déplacement du début du développement |
Post-déplacement | Prédéplacement |
| Déplacement de la fin du développement |
Progenèse (fin prématurée) | Hypermorphose (fin retardée) |
Exemples d’hétérochronie
Bivalves
Les caractéristiques animales qui ont évolué par processus hétérochroniques sont bien entendu omniprésentes (la formation de la queue des dipneustes par pédomorphie[5], la variabilité des becs des pinsons des îles Galapagos[4], etc.). Un des cas les plus frappant est celui des bivalves du genre Cardium. L’espèce C. plicatum a un stade juvénile avec des épines (voir fig. 1). Lorsqu’elle devient mature, les épines disparaissent et le nombre de côtes augmente. L’espèce C. fittoni, quant à elle, possède une forme mature avec un nombre réduit de côtes et les épines sont maintenues tout au long de la vie de l'individu. Cette deuxième espèce aurait donc l’aspect juvénile de l’espèce C. plicatum à maturité, correspondant donc à un exemple clair de néoténie[3].

Animaux éteints
Parmi les animaux éteints, les pattes arrière démesurément grosses des tyrannosaures ainsi que la taille réduite des pattes antérieures seraient dues à des changements hétérochroniques[1]. Les marsupiaux éteints du genre Patagosmilus ont des dents de sabres qui seraient également dues au phénomène de l’hétérochronie. Le changement dans ces dents par rapport aux autres marsupiaux serait péramorphique[6].
Plantes
Il existe aussi des changements hétérochroniques chez les plantes. Pour ne citer qu’un exemple, des recherches ont mis en lumière plusieurs différences dans le moment de la fin de la méiose, de la maturation des mégaspores et de la formation du sac embryonnaire entre certaines espèces du genre Tripsacum. Les différences entre ces espèces sur ces moments sont des hétérochronies[7].
Cichlidés
Dans le Lac Malawi, il y a une différence accrue dans la sensibilité visuelle entre différentes espèces génétiquement rapprochées de cichlidés, une famille de poissons trouvée entre autres dans les Grands Lacs d’Afrique qui présente généralement beaucoup de variations morphologiques entre espèces et populations. Est-ce que cette différence est causée par un changement de la vitesse et de la durée de développement des patrons d’expression des gènes d’opsine, des protéines qui composent les pigments visuels?
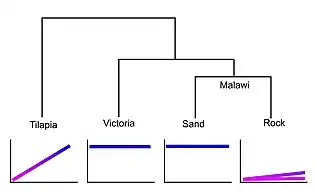
Les acides aminés formant les protéines d’opsine déterminent le spectre de lumière qui peut être absorbé par le pigment visuel qu’elles composent. Les espèces étudiées ont les mêmes 7 gènes de cônes d’opsine, mais la différence entre les espèces dans le temps et la durée d’expression de chaque gène serait indicatrice d’un changement hétérochronique. Une espèce de Tilapia (Oreochromis niloticus), un cichlidé riverain, est utilisée comme exogroupe (outgroup), donc comme espèce de référence, aux espèces du Lac Malawi pour comparer leurs développements des patrons d’expression des opsines et ainsi voir quels changements sont survenus depuis le dernier ancêtre commun.
La comparaison effectuée grâce à une PCR quantitative montre que le Tilapia a différentes phases d’expression des gènes d’opsine du stade larvaire au stade adulte, en passant par le stade juvénile. Donc les gènes d’opsine sont exprimés différemment selon l’âge des poissons, ils sont plus nombreux et complexes chez les larves et juvéniles des Tilapias. Chez le Tilapia adulte, il y a une transition vers l’expression des gènes d’opsine sensibles à des longueurs d’onde plus longues qui pourraient être un avantage dans les rivières plus turbides dans lesquelles ils vivent. Chez les espèces de cichlidés du Lac Malawi, deux patrons de développement ont été observés. Les espèces vivant près des roches vont avoir une expression des gènes d’opsine sensibles aux courtes longueurs d’onde, comme pour au stade larvaire des Tilapias, qu’ils vont maintenir toute leur vie ou passer à l’expression correspondant à celles des Tilapias juvéniles. Les espèces vivant près du sable quant à elles dès leur stade larvaire vont avoir un développement direct de l’expression des gènes d’opsine similaire aux Tilapias adultes, qui sont sensibles aux longues longueurs d’onde, et elles maintiennent cette expression.
La variation de sensibilité visuelle chez les cichlidés du Lac Malawi serait causée par un changement hétérochronique dans les patrons d’expression des gènes d’opsine. Les espèces des milieux rocheux présentent une néoténie en conservant le patron d’expression associé aux stades larvaires ou juvéniles d’une espèces de Tilapia. Les espèces de milieux sableux présentent un développement direct en ayant, dès leur stade larvaire, les gènes d’opsine associés aux adultes exprimés[8].
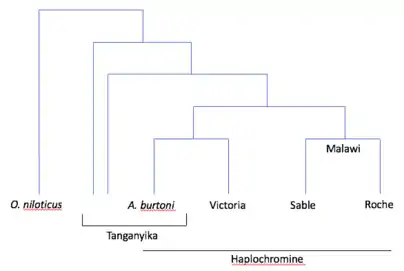
Les variations dans l’expression d’opsine chez les cichlidés seraient donc causées par des changements hétérochroniques dans les patrons développementaux de l’expression des gènes d’opsine. Quand est-ce que ces changements se sont-ils produits durant l’évolution de cette famille de poissons?
Des cichlidés adultes du Lac Malawi et du Lac Tanganyika ont des patrons d’expression d’opsine très similaires résultant d’une évolution parallèle. Cette évolution parallèle aurait peut-être été causée par des changements hétérochroniques à partir des ancêtres respectifs qui auraient exprimé les mêmes opsines des cichlidés adultes des deux lacs, mais au stade juvénile. Déterminer à quoi ressemblait le patron de développement de l’expression d’opsine de l’ancêtre des cichlidés du Lac Malawi permet de déterminer le moment des changements hétérochroniques. Si le patron de développement de l’ancêtre avait un développement direct ou néoténique, comme chez les poissons du Lac Malawi, les changements hétérochroniques ont eu lieu il y a plus longtemps, après la séparation avec la lignée du Tilapia. Alors que si le développement était plutôt progressif, comme chez le Tilapia (O. niloticus), les changements ont été plus récents et la ressemblance entre les espèces des lacs Malawi et Tanganyika viendrait de changements hétérochroniques indépendants, mais semblables, dans l’expression des opsines.
L’expression des gènes d’opsine chez Astatotilapia burtoni, une espèce basale des haplochromines (tribu des cichlidés), permet de déterminer le patron de développement de l’ancêtre. L’espèce est considérée par plusieurs comme étant très similaire à l’ancêtre commun des haplochromines et comme ayant une position intermédiaire dans l’évolution entre les cichlidés du Lac Tanganyika et ceux du Lac Malawi.
Les analyses du développement de l’expression des gènes d’opsine chez A. burtoni indiquent que l’espèce montre un patron de développement progressif, tout comme O. niloticus. Cela implique donc que les changements hétérochroniques se sont produits plus récemment dans l’évolution des cichlidés. Plus précisément, ils se seraient produits après la séparation des lignées du Lac Malawi et du Lac Victoria. La similarité des patrons de développement chez les cichlidés du Lac Tanganyika est causée par des changements hétérochroniques parallèles[9].
Mammifères
Les mammifères ne sont pas exemptés des changements hétérochroniques. Plusieurs de ceux-ci sont retrouvés parmi ces animaux comme les transformations dans le développement crânien. L’hétérochronie permet, entre autres, d’expliquer la grande gamme de différences qui existent entre les crânes des divers mammifères[10] - [11].
Différences crâniennes avec les autres amniotes
Lors de la divergence des mammifères par rapport aux autres amniotes, plusieurs changements se sont produits les distinguant de leurs ancêtres reptiliens. Ainsi, le crâne fut l'une des structures affecté et ayant subi des changements d’ordre hétérochroniques. À partir de l’ancêtre commun mammalien, des modifications subséquentes du patron de développement crânien ont eu lieu pour générer l’ensemble des crânes très variés des lignées actuelles de mammifères[11]. Quels étaient donc les patrons ancestraux de développement crânien des mammifères et les facteurs qui les ont influencés?
_(14763307141).jpg.webp)
L’ossification du crâne est importante lors du stade embryonnaire. Étant différents entre les divers ordres de mammifères, les patrons de développement crâniens nécessitent des analyses sur un éventail important d’espèces distinctes. L’utilisation d’organismes modèles ne suffisant pas, une étude exhaustive des crânes embryonnaires de 134 espèces (102 provenant des différents ordres de mammifères et 32 provenant de sauropsides, des amniotes non mammaliens) a dû être réalisée pour élucider le mystère. Grâce aux nouvelles avancées dans les techniques d’imagerie à haute résolution, la séquence développementale crânien du dernier ancêtre commun des mammifères a pu être déterminée[11].
Ainsi, le timing de la formation des os du crâne mammalien est fortement influencé par deux facteurs : le développement modulaire de ceux-ci et la taille du cerveau. Dans un premier temps, la genèse des os crâniens est modulaire et ne s’effectue pas au même moment. Un premier module est formé tôt et se compose uniquement d’os plats. L’autre module est constitué exclusivement d’os endochondraux et parait être forcé à s’ossifier plus tardivement. Ce développement modulaire causé par des modes d’ossification distinctes semble être une contrainte évolutive. Ce développement en deux phases entraine probablement de la covariance entre les os d’un même module. D’autre part, ce phénomène pourrait aussi laisser place à une évolution plus indépendante des os de modules distincts[11].
Dans un deuxième temps, la reconstruction de la séquence développementale crânienne du dernier ancêtre commun des mammifères a permis de déceler des os particuliers ayant subi des changements hétérochroniques par rapport à l’ancêtre reptilien. En effet, les os frontal, pariétal, basioccipital et supraoccipital du neurocrâne ont connu une accélération marquée de leur ossification chez l’ancêtre mammalien[11].
Le supraoccipital représente un os endochondral spécialement intéressant, car il se développerait plus tôt chez tous les amniotes possédant des dégrées d’encéphalisation élevés. Il semblerait posséder une certaine liberté évolutive par rapport aux autres os endochondraux. Parmi les mammifères, son développement est particulièrement plus rapide que les autres amniotes. Le timing développemental du supraoccipital pourrait donc prédire la taille du cerveau au sein des mammifères. Après l’accélération initiale de sa formation durant la divergence avec les autres amniotes, le timing de développement de cet os est resté constant chez les monotrèmes, les marsupiaux et l’ancêtre des placentaires. Toutefois, parmi les différentes lignées de placentaires, des accélérations subséquentes et indépendantes d’ossification sont survenues. On retrouve ces changements hétérochroniques notablement au sein des cétacées et les primates. Entre ces derniers, l’humain est l’espèce présentant le degré d’encéphalisation le plus important et la plus forte accélération de l’ossification du supraoccipital[11].
Longueur des visages
On retrouve également parmi les mammifères d’importantes variations de longueurs faciales. On peut retrouver au sein d’un même taxon des espèces à visage court et d’autres à visage long[10]. Un exemple flagrant est la multitude d’allures que peuvent prendre les têtes des races de chiens.
Le visage est formé à partir d’os faciaux du splanchnocrâne. Il existe une covariance dans le développement du visage et celle de la boite crânienne chez les mammifères. Ainsi, lorsque l’un varie au cours de l’évolution, l’autre est aussi plus ou moins modifié. Toutefois, les os faciaux ne se forment pas à la même vitesse que ceux du neurocrâne au cours de l’ontologie ce qui constitue un exemple de croissance allométrique. Cette dernière permet une grande flexibilité dans les formes de splanchnocrânes et explique, en partie, l’importante variété de morphologie crânienne des mammifères. Lors du développement embryonnaire, il est commun d’observer un passage de la brachycéphalie (visage court) à la dolichocéphalie (visage long) en raison de la croissance plus rapide des os faciaux[10]. Alors, est-il possible qu’il y ait présence d’une corrélation entre la taille de l’animal et la dolichocéphalie également au niveau des espèces?
Cardini et Polly ont tenté de répondre à cette question[10]. Ceux-ci ont étudié les changements craniofaciaux parmi quatre groupes différents de placentaires : les antilopes, les chauves-souris à fruit, les mangoustes africaines et les écureuils arboricoles africains. Tous ces groupes ont leur dernier ancêtre commun très tôt dans l’arbre des placentaires. Pour ce faire, ils ont repéré diverses structures crâniennes sur les différents spécimens et mesuré les changements de leur position entre chaque espèce. Ils ont ainsi exposé la présence d’une contrainte évolutive dans le développement craniofacial s’étendant à l’ensemble des mammifères. La taille absolue d’une espèce semble bel et bien influencer la longueur de son visage. Dans ce sens, plus un organisme est imposant, plus il y a de probabilités que son visage soit allongé. Par contre, la brachycéphalie est prédite pour les espèces de petite taille. Cette relation est conservée parmi les différents clades de placentaires et dicte leur développement crânien. Ainsi, la longueur des visages ne dépend pas seulement de la croissance ontogénique, mais également de la taille à l’âge adulte de l’espèce. Dans ce sens, la masse corporelle des espèces pourrait expliquer la forte diversité de longueur faciale des mammifères, car leur disparité en taille est beaucoup plus importante que chez les autres groupes de vertébrés. Cependant, il existe des exceptions à cette hypothétique règle. L’humain en fait partie avec un visage n’étant pas suffisamment long pour sa grande taille[10].
D’un autre côté, le raccourcissement du visage est aussi une caractéristique de la domestication. En effet, lors de la domestication, ce sont les individus de petite taille qui sont souvent sélectionnés expliquant les visages réduits des chats, des porcs et d’autres animaux domestiques[10].
Hétérochronie transcriptionnelle des autopodes chez les taupes
Le squelette adulte des taupes (de la famille des Talpidés) présente de nombreuses spécialisations liées à leur mode de vie souterrain, dont des mains élargies par rapport aux pieds. L'hétérochronie qui survient dans les mécanismes de développement devrait être en mesure d’expliquer l'évolution morphologique des éléments du squelette (donc leur forme, apparence). Une étude a été menée afin de comprendre la cause qui pourrait justifier une différence dans le développement du membre chondral, c’est-à-dire le cartilage, ainsi que des variations de taille chez les autopodes, les membres antérieurs et postérieurs adultes[12]. Est-ce qu’une hétérochronie transcriptionnelle peut conduire à un motif morphologique?
Il serait intéressant de définir d’abord l’hétérochronie transcriptionnelle. Elle décrit les modifications temporelles de l’expression des gènes du développement pouvant mener à un motif d’hétérochronie. Quelques exemples ont été rapportés dans lesquels des changements temporels dans les mécanismes de développement entre les membres antérieurs et postérieurs peuvent entraîner une variation morphologique, notamment chez l’organisme modèle Xenopus laevis[12]. En effet, la variation morphologique des éléments carpiens (os des mains) et tarsiens (os des pieds) de la grenouille Xenopus laevis pourrait être déterminée par un allongement hétérochronique de l’expression d’un gène Hox. Autrement dit, il est possible d’observer une différence dans les membres antérieurs et postérieurs de la grenouille en étendant l’expression temporelle d’un certain gène.
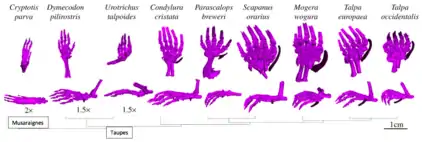
La chondrogenèse est le processus selon lequel le cartilage se forme. Au niveau moléculaire, celle-ci est possible grâce au marqueur précoce de la chondrification; le facteur de transcription SOX9[12]. Il s'agit de l'un des plus anciens marqueurs du mésoderme des membres chondrogéniques et il est impliqué dans la différenciation des chondrocytes (cellules composant le cartilage). Des chercheurs ont analysé la distribution temporelle et spatiale de l’expression de SOX9 dans les autopodes d’embryons de taupes, dont Talpa occidentalis, en comparaison à ceux d’un embryon de musaraigne (Cryptosis Parva) et de souris (Mus Musculus)[12]. Des hybridations et des préparations histologiques ont été réalisés sur ces embryons. L’observation majeure fut la suivante : Talpa occidentalis montre une accélération relative de l’expression de SOX9 dans les mains par rapport aux pieds, alors que chez la musaraigne, l’expression de SOX9 est synchrone dans les mains et les pieds. En d’autres termes, c’est une hétérochronie dans le développement chondral qui a été observée : les membres antérieurs de la taupe montrent un développement avancé par rapport aux membres postérieurs. En revanche, il y a une synchronisation dans l’expression de SOX9 et le développement chondral des membres chez son groupe frère, la musaraigne. De plus, les membres antérieurs des taupes sont plus gros et plus robustes que les membres postérieurs. Les taupes portent une structure supplémentaire particulière, appelée os sésamoïde (ou os falciforme), caractérisée comme étant un os accessoire[12]. Son rôle fonctionnel consiste à agrandir davantage la région autopodiale, servant ainsi à fixer l’animal lors du creusage. C’est particulièrement utile pour ces animaux souterrains.
Ainsi, cette hétérochronie transcriptionnelle dans les autopodes de la taupe explique la modification temporelle dans le développement du membre chondral. De plus, elle démontre la modification morphologique, soit l’élargissement de la main, qui est probablement liée au comportement locomoteur. Cette morphologie plus robuste des membres antérieurs est indispensable pour creuser la terre et rejoindre leur habitat souterrain. Ceci illustre le concept de pénétrance de développement selon lequel la sélection pour un trait adulte peut entraîner des changements significatifs à un stade précoce, embryonnaire, des mécanismes de développement.
Hétérochronie de l’ossification du crâne chez les taupes
Les études hétérochroniques classiques ont quantifié les changements de taille et de forme du crâne des mammifères pour découvrir qu’il subit des changements dans le timing et dans la vitesse de développement lors de son évolution morphologique. Or, Koyabu et al. ont réalisé une étude sur la « séquence » d’ossification crânienne chez le groupe Eulipotyphla (comprenant les musaraignes, les taupes et les hérissons) dans le but d’examiner le changement dans la formation des os crâniens au cours de l’évolution et la modularité du développement[13]. La modularité est un concept clé pour relier la biologie évolutive et la biologie du développement. Elle réfère à l’autonomie de groupes d’évènements ou de structures, ainsi qu’à la forte association d’évènements de développement et de structures morphologiques.
L’équipe a échantillonné 238 spécimens embryonnaires desquels ils ont recueilli des données de séquences d’ossification de 22 éléments crâniens. Des techniques de coloration ont été appliquées afin de détecter l’ossification. D’autres méthodes ont été nécessaires pour évaluer la variabilité d’un élément particulier dans la séquence d’ossification[13].
Habituellement, il est observé, dans l’évolution des mammifères, que la séquence d’ossification crânienne soit assez conservatrice, c’est-à-dire que peu de changements hétérochroniques surviennent. Au cours de l’évolution du groupe Eulipotyphla, certaines hétérochronies se sont produites, notamment une ossification précoce des os de la mâchoire par rapport aux os neuro-crâniens, comme chez la plupart des vertébrés. Cependant, l’hétérochronie caractéristique de ce groupe est le déplacement tardif de l’os lacrymal par rapport à l’os ptérygoïde[13]. Chez les taupes, ils ont observé des caractéristiques considérablement dérivées, telles que le développement accéléré du palatin, du nasal, du ptérygoïde et du vomer (os du nez). Ceci informe que, chez les taupes, le développement précoce du complexe voméronasal est une caractéristique autapomorphique, alors que chez de nombreux mammifères, ces os s’ossifient plus tard[13].

]
La morphologie du rostre (museau) chez les taupes est robuste et en forme de boîte pour permettre de percer le sol. Leur museau est tapissé d’organes mécanosensoriels très sensibles au toucher, appelés organes d’Eimer, que l’on ne retrouve pas chez les musaraignes et les hérissons. La mauvaise vision des taupes est compensée par ces organes très fortement développés qui agissent comme des récepteurs tactiles. Une exception a été noté : alors que les taupes souterraines développent la région voméronasale au début de l’embryogénèse, la taupe Urotrichus talpoides, plus terrestre, montre un décalage secondaire du nez. Celle-ci possède 1310 organes d’Eimer, un nombre réduit comparativement à d’autres véritables taupes. De plus, le complexe voméronasal est réduit de taille et moins robuste. Le sens tactile du rostre est également réduit, puisqu’elles possèdent, comme les musaraignes, un rostre gracile en pointe pour renifler, mais des yeux fonctionnels[13].
Des transformations morphologiques considérables associées au creusement se sont produites chez la taupe telle qu’une région supraoccipitale (partie supérieure du crâne) plus grande que chez les autres Eulipotyphlanes. Cet agrandissement offre l’espace nécessaire pour fixer le muscle rhomboïde élargi qui représente le muscle principal de creusement, alors qu’il est relativement petit chez les mammifères. Puisque le supraoccipital élargi constitue le site de fixation du muscle rhomboïde, son apparition précoce peut être couplée à l’élargissement de cet os chez les taupes. En parallèle, la réduction de la taille occipitale chez Urotrichus talpoides peut expliquer l’importance réduite de creuser[13].
Cette étude approfondie de la formation du crâne chez les mammifères Eulipothyphlan a révélé d’importantes hétérochronies dans l’apparition de l’ossification. Un changement précoce du développement du complexe voméronasal est survenu chez l’ancêtre commun des taupes. Ce changement est probablement associé à l’importance accrue du rostre pour le creusage et à son utilisation pour la détection tactile dans la vie souterraine. Chez les musaraignes, le nez subit un développement tardif. Ce second changement dans l’évolution du développement peut être lié au renversement du mode de vie terrestre et à la réduction de la fonction du rostrum.
Hétérochronie chez l’Homme
La conception la plus répandue sur l’hétérochronie chez l’Humain est que la néoténie est le processus qui nous a différencié le plus par rapport à nos ancêtres et du même coup aux singes proches de nous (théorie appuyée autrefois par certains grands noms dans le domaine de la génétique évolutive du développement comme Stephen Jay Gould[3]). Or, selon des recherches plus récentes, cette idée serait fausse[4], puisque d'autres processus hétérochroniques jouent un rôle beaucoup plus grand que la néotonie, notamment dans le développement de notre crâne, de notre aspect général (phases du développement) et dans le développement de notre bassin.
Le crâne
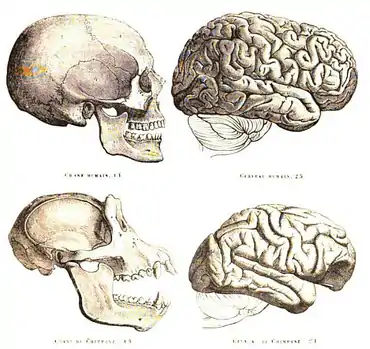
Le crâne a été une des structures visées pour tenter de prouver que l'Homme serait néoténique. Selon l'hypothèse, il serait le résultat d’un ralentissement dans le développement qui expliquerait pourquoi le crâne d’un humain adulte aurait l’apparence d’un crâne de singe juvénile. Or, les changements qui ont été appliqués au cours de l’évolution sur le crâne humain ne sont pas dus à des ralentissements (néoténie), comme le suggère cette théorie, mais plutôt à un amalgame de processus hétérochroniques dont la néoténie ne serait même pas dominante. Des recherches suggèrent en effet que «la forme arrondie du crâne juvénile et la position inférieure du trou occipital, se maintenant jusqu’au stade adulte chez l’Homme, sont vraisemblablement à rapporter à un processus [de progenèse]» (Chaline et al., 1998, p. 297). La progenèse serait également derrière le fait que l’Homme n’a pas, contrairement à plusieurs singes dont notamment le gorille, de bourrelet sus-orbitaire, de canines en croc ou de muscles masticateurs prépondérants. La conception que le développement du crâne se fait par néoténie passe aussi à côté du fait que le développement neuronal au sein même du crâne a subi des changements hypermorphiques au cours de l’évolution. Finalement, certains autres aspects du crâne humain se sont différentiés de ceux de nos ancêtres par post-déplacement[14].
L'aspect global
L’aspect et le développement général de l’Homme seraient dictés par le phénomène d’hypermorphose. À première vue, cela semble contre-intuitif, puisque comparativement à l’espèce la plus proche de nous, le chimpanzé, l’humain semble se développer plus lentement. En effet, le chimpanzé atteint sa phase adulte vers dix ans, alors que l’humain amorce à peine sa phase juvénile à cette période. Ce semblant de développement «retardé» a été une des prémisses de l’hypothèse que la néoténie définissait en grande partie l’Homme. En fait, cette impression serait due au fait que l’humain prolonge chacune de ses phases de développement (hypermorphose) par rapport aux grands singes. En termes de temps absolu, l’Homme quitte donc chaque phase de son développement après les chimpanzés, mais cela ne veut pas dire que la vitesse du développement humain est plus lente (ce qui aurait caractérisé la néoténie). Une hypothèse pour les bénéfices des caractéristiques hypermorphiques chez l’Homme, outre l’augmentation du volume corporel, est l’augmentation de la période d’apprentissage, un développement accru du cerveau ainsi qu’une espérance de vie plus longue, ce qui favorise la transmission des savoirs[4].
Le Bassin
Des études ont également tenté de retracer les changements hétérochroniques qui ont transformé le bassin, une structure clé pour la capacité à marcher chez l’Homme. À l’instar du crâne, les changements apportés sur le bassin seraient une mosaïque de procédés. Certains changements, comme l’amincissement de la portion antérieure de l’ilium, seraient pédomorphiques. D’autres, comme l’apparition plus hâtive du contrefort acetabulo-cristal (un éperon osseux lié au bipédisme) dans le développement de l’Homme seraient des péramorphies[15]. Ces nuances apportées au développement de caractéristiques aussi importantes que celles qui ont poussé l’Homme au bipédisme ajoutent à l’incertitude de la théorie voulant que la néoténie soit le processus le plus déterminant chez l’humain.
Hétérochronie induite en laboratoire
Il est possible d’observer des changements hétérochroniques, sur les plantes notamment, en les induisant en laboratoire. Le genre Pisum a été utilisé comme modèle et il a été démontré que des mutants hétérochroniques pouvaient être formés en jouant avec les gènes qui contrôlent soit la phase développementale végétative ou celle reproductive. Par exemple, certains mutants continuaient à croître plus longtemps que le type sauvage. Ce type de mutant prenait cependant plus de temps à fleurir, mais avait en bout de ligne une apparence péramorphique (plus grande taille, feuille avec plus de folioles, etc.). On pourrait donc dire que le mutant serait hypermorphique comparativement au type sauvage. D’autres mutants, à l’opposé, arrêtaient de croître prématurément, témoignant du phénomène de progenèse.
Cette expérience n’est qu’un des multiples exemples qui prouvent le potentiel incroyable que l’hétérochronie possède pour influencer l’évolution. En effet, de simples mutations induites en laboratoires ont permis de modifier de façon non négligeable le phénotype d’individus du genre Pisum, sans toutefois les rendre non-viables. On pourrait même facilement envisager que les individus progénésiques, par exemple, auraient un meilleur fitness dans les milieux où la période de croissance est plus courte. On a donc une bonne idée de ce que l’hétérochronie peut faire au point de vue évolutif[16].
Hétérochronie en tant que polyphénisme

Les changements hétérochroniques importants ne sont pas toujours engendrés par des mutations. Parfois, ils peuvent simplement être le résultat d’un polyphénisme. C’est le cas chez plusieurs espèces d’urodèles qui possèdent une pédomorphose facultative. Les espèces concernées auront donc deux formes possibles : les pédomorphes et les métamorphes. Les pédomorphes conserveront leurs traits juvéniles même après avoir atteint leur maturité sexuelle. Souvent, ces traits seront associés au mode de vie aquatique larvaire (branchies, etc.). Quant aux métamorphes, ils subiront une métamorphose qui les fera passer de l’état larvaire aquatique à l’état adulte terrestre avant d’atteindre leur maturité sexuelle. Nous aurons donc, au sein d’une même espèce, des individus aquatiques pédomorphiques et des individus terrestres métamorphosés.
La forme pédomorphique sera plus abondante dans des milieux où il y a peu de prédateurs tel le poisson. En l’absence de cette prédation, elle peut coloniser un milieu évidemment inaccessible pour les adultes métamorphes terrestres. Si en revanche il existe une forte concentration de prédateurs dans un plan d’eau, la forme terrestre sera plus abondante, puisque les individus auront avantage à quitter le milieu aquatique rapidement pour compléter leur cycle de vie.
Ce polyphénisme est avantageux puisqu’il permet de coloniser divers milieux. Il est également profitable que les deux formes ne se spécifient pas, puisqu’un assèchement d’un plan d’eau pourrait amener l’extinction de la forme pédomorphique, si ce n’était pas des individus terrestres qui survivent et qui portent dans leurs gènes le caractère pédomorphique. Les deux formes sont donc complémentaires et assurent une meilleure valence écologique à l’espèce[1].
Notes de référence
- Mathieu Denoël, 2001, Eco-éthologie des populations pédomorphiques du triton alpestre, Triturus alpestris (Amphibia, Caudata), Cahiers d’éthologie fondamentale et appliquée, animale et humaine, vol 21, 338 pages
- Gavin de Beer, 1930, Embryology and evolution
- Stephen Jay Gould, 1977, Ontogeny and Phylogeny, Cambridge : Belknap Press, 501 pages
- Micheal L. McKinney et Kenneth J. McNamara, 1991, Heterochrony, The Evolution of Ontogeny, New York : Plenum Press, 437 pages
- Wiliam E. Bernis, 1984, Paedomorphy and the Evolution of the Dipnoi, Paleobiology, vol 10, p. 293-307
- (en) Analía M. Forasiepi et Marcelo R. Sánchez-Villagra, 2014, Heterochrony, dental ontogenetic diversity, and the circumvention of constraints in marsupial mammals and extinct relatives, , vol 40, p. 222-237
- Jane Ellen Bradley, John G. Carman, Michelle S. Jamison et Tamara N. Naumova, 2007, Heterochronic features of the female germline among several sexual diploid Tripsacum L. (Andropogoneae, Poaceae), Paleobiology, J. evol. Biol., vol 7, p. 447-465
- Karen L Carleton, Tyrone C Spady, J Todd Streelman et Michael R Kidd, « Visual sensitivities tuned by heterochronic shifts in opsin gene expression », BMC Biology, vol. 6, no 1, (ISSN 1741-7007, DOI 10.1186/1741-7007-6-22, lire en ligne, consulté le )
- Kelly E. O'Quin, Adam R. Smith, Anit Sharma et Karen L. Carleton, « New evidence for the role of heterochrony in the repeated evolution of cichlid opsin expression », Evolution & Development, vol. 13, no 2, , p. 193–203 (ISSN 1520-541X, DOI 10.1111/j.1525-142x.2011.00469.x, lire en ligne, consulté le )
- (en) Andrea Cardini et P. David Polly, « Larger mammals have longer faces because of size-related constraints on skull form », Nature Communications, vol. 4, no 1, , p. 2458 (ISSN 2041-1723, DOI 10.1038/ncomms3458, lire en ligne, consulté le )
- (en) Daisuke Koyabu, Ingmar Werneburg, Naoki Morimoto et Christoph P. E. Zollikofer, « Mammalian skull heterochrony reveals modular evolution and a link between cranial development and brain size », Nature Communications, vol. 5, no 1, , p. 3625 (ISSN 2041-1723, PMID 24704703, PMCID PMC3988809, DOI 10.1038/ncomms4625, lire en ligne, consulté le )
- Constanze Bickelmann, Christian Mitgutsch, Michael K. Richardson et Rafael Jiménez, « Transcriptional heterochrony in talpid mole autopods », EvoDevo, vol. 3, no 1, , p. 16 (ISSN 2041-9139, PMID 22873211, PMCID PMC3441920, DOI 10.1186/2041-9139-3-16, lire en ligne, consulté le )
- Daisuke Koyabu, Hideki Endo, Christian Mitgutsch et Gen Suwa, « Heterochrony and developmental modularity of cranial osteogenesis in lipotyphlan mammals », EvoDevo, vol. 2, no 1, , p. 21 (ISSN 2041-9139, PMID 22040374, PMCID PMC3247175, DOI 10.1186/2041-9139-2-21, lire en ligne, consulté le )
- Jean Chaline, Bruno David, Françoise Magniez-Jannin, Anne Dambricourt Malassé, Didier Marchand, Frédéric Courant et Jean-Jacques Millet, 1998, Quantification du crâne des Hominidés et hétérochronies, Académie des sciences de Paris, science de la terre et des planètes, page 292-298
- Christine Berge, 1998 Heterochronic Processes in Human Evolution: An Ontogenetic Analysis of the Hominid Pelvis, American journal of physical anthropology, vol 105, p. 441-459
- R. J. E. Wiltshire, I. C. Murfet et J. B. Reid, 1994, The genetic control of heterochrony: Evidence from developmental mutants of Pisum sativum L., Sex plant reprod, vol 20, p. 9-17