Glandes gnathocoxales
Les glandes gnathocoxales, qualifiées aussi de glandes salivaires, sont des organes sécréteurs péri-buccaux situés dans les gnathocoxae ou lames maxillaires des Araignées. Elles présentent fréquemment un dimorphisme sexuel remarquable.
Elles ne doivent pas être confondues avec les glandes épidermiques en coussins, partie différenciée du tégument gnathocoxal.
Introduction
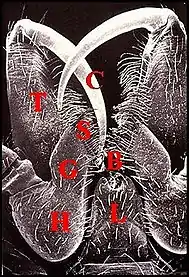
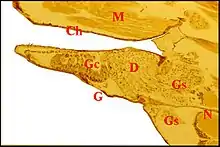
Les pédipalpes (palpes) d’Araignées sont des appendices prosomatiques très importants différenciés chez le mâle en organes d’accouplement dont un bulbe copulateur. Leur hanche ou coxa est insérée sur le côté de la lèvre inférieure (labium) et limite donc la bouche latéralement. Chez les Liphistiomorphes et beaucoup de Mygalomorphes, elle ne diffère de celle des pattes ambulatoires que par une brosse de poils utilisée pour la filtration des aliments. En revanche, chez d’autres Mygalomorphes, elle présente une nette protubérance antéro-interne qui s’individualise en lame maxillaire dans le cas des Aranéomorphes. Cette gnathocoxa (gnathocoxe) a une forme et un développement variables, peut devenir beaucoup plus volumineuse que la hanche elle-même et présente un bord interne aminci dont la brosse de poils est appelée scopula. Son sommet porte une serrula, carène denticulée et tranchante Ces différenciations permettent à l’ Araignée de déchirer et mastiquer ses proies, d’où son autre nom de patte-machoire donné au pédipalpe (Fig. 1).
Les lames maxillaires contiennent des glandes dites gnathocoxales ou salivaires découvertes par Campbell (1881) et ne devant pas être confondues avec les glandes péri-buccales maxillaires en coussinet. Il était communément admis que leur nombre et leur importance varient selon les familles, qu’elles ont une structure uniforme considérée comme acineuse par Millot (1968) et qu’elles présentent tout au plus des variations numériques entre le mâle et la femelle (Legendre, 1953).
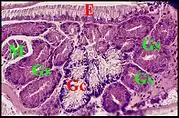
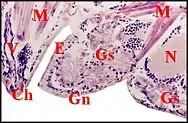
En fait, les glandes gnathocoxales (maxillaires ou salivaires) de certaines Araignées présentent un dimorphisme sexuel remarquable. Observé pour la première fois dans les coupes histologiques d' un mâle d’Araniella cucurbitina (Clerck) (Fig. 2), d'ailleurs photographié sur le terrain avant sa capture[1], il a été signalé ultérieurement chez d’autres Araneidae, chez des Linyphiidae [2] et retrouvé ensuite dans plusieurs genres de ces mêmes familles, dont la remarquable Kaira alba[3](Fig. 4), Lepthyphantes[4] ainsi que chez les Leptonetidae[5] - [6] - [7].
Ce dimorphisme est lié à la présence, chez le seul mâle, de glandes particulières qui siègent dans la gnathocoxa avec les glandes salivaires classiques qu’elles entourent. Elles peuvent y rester confinées ou la déborder pour s’engager plus ou moins largement dans le prosoma, ont une structure acinoïde et renferment, dans leurs cellules glandulaires ou adénocytes, des grains de sécrétion que l’éosine colore intensément, d’où le nom de « glandes à grains éosinophiles » qui leur a été attribué initialement[2] avant d’être remplacé, faute de mieux, par l’appellation « glandes sexuelles »[1].
Localisation et rapports

Ils varient sensiblement selon les familles et même dans certains genres.
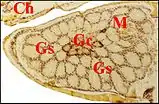
Chez les Araneidae, la sous-famille des Araneinae semble offrir seule un dimorphisme sexuel : Araniella cucurbitina (Fig. 2), Araneus quadratus, Nuctenea cornuta et sclopetaria, Aculepeira ceropegia (Fig. 3) et annulipes, Cyclosa conica et caroli, Zygiella x-notata, Kaira alba (Fig. 4), Wixia ectypa, Micrathena schreibersi[8]. Les glandes sexuelles mâles y occupent une grande partie de la lame maxillaire mais n’en débordent pratiquement pas (Fig. 2 à 4). Ainsi sont-elles baignées en totalité par son sinus hémolymphatique tout comme les glandes classiques ou banales des femelles d’Araneinae quelle qu’en soit l’espèce et toutes proportions corporelles gardées. Fait important, ces mêmes genres ont un palpe dont le style est dépourvu de coiffe embolique ou ne se rompt pas lors de la copulation[1] - [9]. En revanche, les mâles d’Araneinae sans glandes sexuelles possèdent une coiffe ou du moins, un embolus qui subit une rupture apicale in copula (Araneus, Neoscona, Nemoscolus, Metepeira).
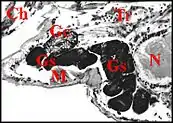
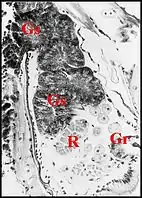
Chez les Linyphiidae et les Erigoninae, deux sous-familles bien séparées au sein des Linyphiidae, les glandes sexuelles mâles débordent en revanche largement des gnathocoxae ou lames maxillaires (Fig. 5, 6) alors que les glandes classiques y restent confinées (genres Linyphia, Lepthyphantes, Tapinopa, Pityohyphantes, Erigone, Styloctetor, Grammonota, Moebellia, Wideria, Hypomma [1] - [10] - [8].
Elles semblent envahir littéralement l’interstitium du céphalothorax (prosoma) et y deviennent en quelque sorte ectopiques, parfois à un tel degré que leurs canaux excréteurs restent seuls en place dans la lame maxillaire avec les glandes classiques.
Les glandes sexuelles mâles constituent schématiquement trois groupes acineux de localisations différentes.
Un groupe antéro-inférieur, intra-gnathoxoxal, correspond à celles qui sont demeurées en place dans la gnathocoxa et y entourent les glandes « classiques ».
Un groupe postérieur, rétro-pharyngien et sous-neural, s’interpose entre l’épiderme (hypoderme) ventral et la face inférieure des ganglions nerveux thoraciques sous-œsophagiens (Fig.). Il entre aussi en rapport avec des néphrocytes, les glandes coxales, les glandes rétro-gnathocoxales, du tissu réticulé (organe antérieur de Legendre,1959) et peut atteindre un volume considérable, jusqu’à 500 µm de long chez le mâle minuscule de l’ Erigonine Styloctetor penicillatus (1,7 mm).

Un groupe supérieur, précérébrale, coiffe les ganglions sus-œsophagiens, encadre la cavité buccale et s’insinue sous les glandes à venin. De plus, il s’engage fréquemment dans l’interstitium du rostre, paraît s’y incarcérer et entre ainsi en rapport plus ou moins direct avec du tissu réticulé, la glande rostrale , l’endosternite et divers faisceaux musculaires (Fig.7, 8). Une telle « incarcération » ou pénétration rostrale peut d’ailleurs s’observer dans le cas de certaines glandes à venin (Filistata, Pholcidae ; Diguetidae) et des diverticules intestinaux prosomatiques (Eresidae ; Hersiliidae).
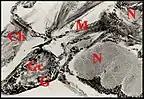
Chez les Leptonetidae, à côté des glandes classiques, seules présentes chez les femelles (Fig. 9), les glandes sexuelles mâles occupent la partie proximale de la gnathocoxe et pénètrent également dans le céphalothorax. Elles y contractent des rapports de contiguïté presque aussi étendus que ceux des Araneidae et Linyphiidae avec le rostre, sa glande le pharynx, les glandes venimeuses, la partie antérieure du syncerebron et la masse ganglionnaire sous-œsophagienne. Elles ont été découvertes chez Leptoneta infuscata minos (Avant-monts, Montagne noire, ouest de l’Hérault[11], décrites ensuite chez L.microphthalma[5](Fig.) et retrouvées enfin chez 11 autres espèces et sous-espèces (France, Espagne) ainsi que dans le genre Paraleptoneta (P. bellesi)[7].
Structure histologique
Glandes classiques
Les glandes salivaires classiques de la femelle et du mâle occupent une position surtout centrale dans la gnathocoxes des Araneidae et plutôt distale dans celle des Leptonetidae. Elles sont bien différentes des glandes péribuccales en coussinet. De plus, elles sont remarquablement moins nombreuses que les sexuelles dans toutes les familles (6 en moyenne chez les femelles et 3 chez les mâles). Chacune d’elles est formée par un corps glandulaire et un canal excréteur qui semble le pédiculiser, structure générale décrite par Legendre (1953) dans le cas des Tégénaires.

Le corps a une forme globuleuse (diamètre moyen = 100 µ), évoquant ainsi un acinus et, de ce fait, acinoïde. Il se compose d’adénocytes et d’une cellule intermédiaire. Les adénocytes sont allongés et se disposent radialement en assise unique autour d’une cavité axiale peu visible. Leur noyau basal est volumineux, arrondi et nettement nucléolé. Le cytoplasme abondant paraît criblé de vacuoles que séparent des travées à basophilie diffuse, se colorant en outre par la pyronine (fig.) et lui conférant un aspect spongieux (fig.). La cellule intermédiaire se présente comme un vague liseré frangé séparant la cavité des pôles apicaux adénocytaires. Elle n’est repérable qu’à son noyau clair, visible au niveau de collet.
Le canal excréteur, surtout visible en section transversale, unit le corps glandulaire à un orifice (pore) de la cuticule. Il est plus ou moins oblique, court, assez large, bien délimité et montre une paroi épaisse, acidophile, que flanque le noyau aplati, peu chromatique, d’une cellule satellite. ou canalaire. Dans chaque gnathocoxe, l’ensemble des canaux de glandes classiques converge vers sa face interne, près de la scopula ; leurs orifices s’y groupent en aire (plage) poreuse ou «criblée» (Fig.).
Glandes sexuelles
Comme les précédentes, chacune d’elles est formée par un corps glandulaire et un canal excréteur qui semble également le pédiculiser.
Le corps glandulaire est plus volumineux, plus allongé que celui des glandes classiques (l = 50 à 100 µm ; L = 130 à 250 µm), de forme oblongue surtout marquée chez les Leptonetidae (Fig. 13) et présente ainsi un aspect tubulo-acinoïde (Fig.). Il est encore constitué par des cellules glandulaires ou adénocytes reposant sur une basale et par une cellule intermédiaire repérable à son seul noyau visible près du collet. Les adénocytes sont pyramidaux et convergent vers une lumière axiale étroite, presque virtuelle chez les Leptonetidae, contenant parfois un matériel sécrétoire qui peut la distendre. Chez les Araneidae et les Linyphiidae, leur cytoplasme est souvent empli jusqu’à l’apex par des sphérules acidophiles, grains de sécrétion arrondis colorés par l’éosine en un rouge brillant intense ayant valu aux glandes sexuelles leur appellation initiale. Ces grains captent également le bleu d’aniline mais ne se teintent qu’en rose pâle par la méthode à l’A.P.S. Le cytoplasme n’est basophile que dans sa partie la plus externe où apparaît une faible affinité pour la pyronine (méthode dite de Unna-Pappenheim) (Fig.). Il est fréquent aussi qu’ils s’évacuent des adénocytes pour passer dans la cavité centrale et disparaître presque totalement du corps tubulo-acinoïde. Les cytoplasmes ainsi « déshabités » sont clairs, vacuolisés et offrent un aspect banal, plus proche de celui des glandes « classiques ». Dans le cas des Leptoneta (Leptonetidae), les glandes sexuelles réunies en groupe proximal, ont un corps allongé en « massue », situé en quasi-totalité dans le prosoma (Fig. 10, Fig.11).
Le cytoplasme de ses adénocytes, faiblement colorable, ne contient jamais de grains acidophiles mais est criblé de vacuoles innombrables, assez régulières, sans sécrétion bien visible, lui conférant un aspect spumeux. Le noyau est petit (6 µm), rond, avec des blocs chromatiniens et un nucléole (Fig.). Une cellule intermédiaire, d’abord interprétée à tort comme la partie inférieure de la cellule satellite du canal s’interpose entre cette dernière et les adénocytes. Elle a un cytoplasme clair et un noyau vésiculeux, à nucléole très apparent.

Les canaux excréteurs sexuels des Araneidae, sont brefs, acidophiles, d’à peu près la même longueur que leurs homologues classiques et jamais ramifiés. En revanche, ceux des Linyphiidae sont beaucoup plus spectaculaires. Longs et grêles (d. moyen = 2 µm), ils tendent à se grouper en deux faisceaux, l’un horizontal et dirigé dans le sens postéro-antérieur (Fig.), l’autre descendant, oblique en bas et en dedans vers la gnathocoxa. Ils peuvent aussi se fusionner en troncs communs chitineux de teinte jaunâtre, leur disposition générale étant alors arborescente comme dans certaines formes de la glande clypéale (acronale) chez les Argyrodes. Les canaux excréteurs des glandes sexuelles sont toujours accompagnés par des cellules satellites canalaires, peu visibles, repérables à leur seul noyau aplati et en nombre variant selon la longueur des conduits, donc impossible à préciser. Ils se terminent à la partie interne de la gnathocoxa, par des pores siégeant sur la plage criblée, au milieu des orifices homologues des glandes classiques.
Les canaux excréteurs des Leptonetidae sont plus longs que ceux des glandes classiques, grêles, arrondis, réguliers et chacun accompagné par une cellule satellite canalaire remarquablement apparente (Fig. 12). Elle est en effet de très grande taille (L = 100 µm), prismatique allongée, avec un cytoplasme clair vacuolisé de contour polygonal, un noyau excentrique aplati, à chromatine très fine, et entoure le canal qui y occupe en général une position axiale. Ce conduit est peu net dans les coupes longitudinales mais beaucoup plus visible en section transversale, sous la forme d’un anneau minuscule inscrit dans le polygone cellulaire et relié à la membrane par une densification linéaire (Fig.). Tous les canaux se terminent au fond d’une dépression cuticulaire par un orifice étroit que porte une saillie en forme de papille (Fig.).
Microscopie électronique à balayage
Seules étudiées en détail au M.E.B.[5], les gnathocoxae des Leptoneta sont très allongées et de section triangulaire (Fig.) ; elles montrent une scopula de poils multifides et surtout des pores qui sont les orifices des canaux excréteurs.
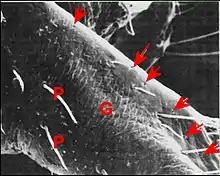
Ces orifices, tous petits et semblables, ne forment chez la femelle qu’un groupe distal situé au-dessous et en dehors de la scopula, entre ses crins, internes, et une rangée externe de brefs poils en surplomb. Ils sont toujours peu nombreux (6 environ), arrondis et adoptent une disposition presque rectiligne
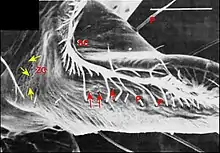
Par contre, chez le mâle , ils constituent deux groupes distincts (Fig.) : l’un antérieur ou distal, formé de 9 pores alignés comme ceux de la femelle (Fig.) ; l’autre postérieur ou proximal, occupant une aire en triangle orientée vers le rostre et le labium (Fig.). Les orifices y sont très nombreux (une cinquantaine), ovales (2,5 µm/1,5 µm), avec une saillie en dôme correspondant à la « papille » du canal excréteur et un bourrelet marginal qui s’étire en raquette (Fig.).

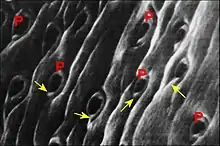
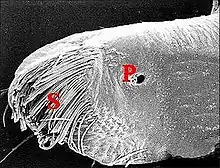
Dans le cas de Leptyphantes sanctivincentii, objet d’une étude plus sommaire, les orifices excréteurs arrondis se mêlent à ceux des glandes salivaires « classiques » au fond d’un « puits » cuticulaire de la gnathocoxe, plage ou aire criblée de la microscopie photonique située très près de la scopula. Il n’y a donc point deux groupes distincts comme chez Leptoneta.
Ultrastructure
Son étude a porté sur Leptyphantes sanctivincentii (Simon) (Linyphiidae) (grotte de Cailhol, Minervois : Ouest de l’Hérault)[12] - [13], Leptoneta microphtalma Simon (grotte de L’Espugne, Saleich, Haute Garonne, France ; grotte de Lestelas, Cazavet, Ariège), examinés en microscopie électronique à transmission, (M.E.T.) au laboratoire souterrain du CNRS et, plus accessoirement, sur Linyphia frutetorum Koch observée de même au laboratoire de l’INRA (St Christol les Alès, 30).
La M.E.T. complète les données histologiques et montre que chaque glande, sexuelle ou classique, peut être considérée comme une unité anatomo-fonctionnelle présentant toujours un même plan ultrastructural. Cette unité comporte : plusieurs adénocytes et une cellule intermédiaire correspondant au corps tubulo-acinoïde, et un canal excréteur ou conducteur qu’entourent jusqu’au pore des cellules canalaires plus ou moins nombreuses, leur ensemble formant un appareil cuticulaire (Schéma).
Glandes classiques
Elles sont appelées glandes de catégorie I dans le cas particulier de Leptyphantes sanctivincentii [12] - [13]
Adénocytes
Chaque adénocyte du corps glandulaire tubulo-acinoïde est une grosse cellule pyramidale dont le pôle apical, serti par la cellule intermédiaire, présente une invagination de l’espace extracellulaire en relation avec la cavité axiale. Cette invagination, souvent très étroite, est bordée par des microvilli irrégulières, enchevêtrées, contenant des microfilaments longitudinaux. Au niveau du pôle basal, qui repose sur une lame, le plasmalemme montre, du moins chez Leptoneta une série de profonds replis compartimentant le hyaloplasme. Dans le cas du même genre, les faces latérales s’engrènent par des interdigitations tandis que des axones riches en petites vésicules claires et en grains de sécrétion à cœur dense (amines biogènes) courent entre leurs plasmalemmes (Fig.). Le noyau présente un gros nucléole, une chromatine granuleuse dispersée et est plus ou moins déformé par les organites subcellulaires voisins.
Ces derniers sont essentiellement un réticulum endoplasmique granuleux expliquant la basophilie observée en microscopie optique et un appareil de Golgi à dictyosomes très nombreux chez Leptyphantes, paraissant plus rares chez Leptoneta. Les cisternae du réticulum granulaire élaborent chez Linyphia[1] et chez Leptoneta [6] un matériel dense, opaque aux électrons, et le libèrent ensuite dans des vésicules. Ces dernières, qui correspondent aux vacuoles des coupe histologiques, sont arrondies, juxtaposées, plus ou moins confluentes. Le matériel sécrétoire s’y disperse en devenant moins dense et granuleux. Des microvésicules et fragments de membranes réticulaires peuvent s’y mêler. Chez Leptyphantes (glandes I), les vésicules naissent du Golgi, grossissent progressivement,ont une membrane plus ou moins bien délimitée, renferment un matériel d’opacité variable, peuvent atteindre jusqu’à 5µm (Fig.), gagnent la partie supérieure de l’adénocyte et y confluant en « flaques » polylobées dont le contenu s’extrude dans la cavité extracellulaire entre les pieds des microvilli [12] - [13].
Les autres organites sont des mitochondries allongées, à crêtes parallèles, et des lysosomes opaques.
Cellule intermédiaire
Correspondant bien au liséré acidophile qui entoure la lumière dans les coupes histologiques, elle très irrégulière, comme «découpée-laciniée», soutient les pôles apicaux des adénocytes, réunit ces derniers en un groupement unitaire et assure leur liaison avec le canal excréteur (Schéma). Son extrémité supérieure ou proximale s’invagine, du moins chez Leptoneta, en une cavité extracellulaire prolongeant celles des adénocytes. Ses expansions s’insinuent entre les adénocytes et leur sont unies par des zonulae adherens près des apex. Une jonction annulaire du même type solidarise l’extrémité inférieure ou distale de la cellule intermédiaire et la cellule du canal.
Cas de Leptyphantes
A la suite de la découverte histologique du dimorphisme sexuel «salivaire» chez Lepthyphantes et d’autres taxons du même genre, un premier examen ultrastructural de L.sanctivincentii nous a montré qu’il existe chez le mâle non pas deux comme décrit initialement, mais trois catégories de glandes gnathocoxales, appelées I, II et III et bien une seule (catégorie I) chez la femelle où elle vient d’être décrite.
Les glandes II et III se composent toutes d’unités anatomo-fonctionnelles dont le corps a été seul décrit en détails dans des travaux axés sur leurs remarquables sécrétions, et dont le canal excréteur va s’ouvrir sur la face latéro-interne de la gnathocoxe dans une dépression commune en crypte (« pit »).
Adénocyte
Chaque adénocyte est une grosse cellule pyramidale.
Son pôle apical présente une invagination de l’espace extracellulaire en “cul de sac” occupant le grand axe adénocytaire, souvent très étroite et bordée de microvilli irrégulières et enchevêtrées.
Les grains de sécrétion des glandes II, présents chez le seul mâle, sont nombreux, sphériques, et contiennent un matériel granuleux plus ou moins condensé en mottes irrégulières (Fig.).
Quant aux grains des glandes III, également propres aussi au mâle, ils sont très nombreux, répartis dans tout le cytoplasme, subsphériques et atteignent 3,2 µm de diamètre. D’ une complexité remarquable, ils renferment au moins trois composants : un matériel finement grenu et assez clair ; un matériel marginal en « coiffe » ou


« croissant », plus dense et plus grossier, au moins partiellement d’aspect réticulé ; des granules «riziformes» très caractéristiques de la sécrétion des glandes III.Ces derniers sont bien individualisés, de contours réguliers, d’opacité modérée, de forme ovoïde permettant de les comparer à de petits grains de riz (d’où leur nom) et d’une taille assez constante (longueur : 0,17 µm). (Fig.). Ainsi, l’aspect des grains de sécrétion est extrêmement variable, conditionné par les proportions respectives des trois composants et correspondent sans aucun doute à différents degrés ou stades de maturation. Les granules riziformes semblent se développer à partir de la composante réticulée, passent ensuite dans la phase finement grenue qui devient de plus en plus claire, se fond dans le hyaloplasme tandis que la membrane du grain s’efface, sont ainsi libérés au pied des microvilli, et finalement seuls extrudés dans la lumière de l’acinus qu’ils remplissent (Fig.).
Cellule intermédiaire
La cellule intermédiaire a des contours irréguliers et sertit les parties apicales des adénocytes. Elle est très riche en microtubules.
La cohésion de l’ensemble est assurée par des desmosomes zonaires et des jonctions septées.
Cas de Linyphia
Dans le cas de Linyphia (frontinellina)frutetorum, seule étudiée initialement et de manière succincte au M.E.T., l’adénocyte « sexuel » renferme aussi un réticulum granuleux très développé. Les grains de sécrétion correspondent bien aux sphérules acidophiles de la microscopie photonique (coupes histologiques : C.H.)mais ont un aspect ultrastructural très différent (microscope électronique à transmission : M.E.T.) de ceux de Leptyphantes. Ils sont volumineux, subégaux, réguliers, sphériques mais assez mal délimités, et paraissent formés par des cisternae réticulaires qui s’y reploient en « circonvolutions » et «volutes» tourbillonnantes. Un matériel modérément opaque aux électrons englue et estompe ces curieuses structures en forme de « boule »(Fig.). Chez Linyphia, dans les adénocytes classiques où ne sont visibles que des vacuoles juxtaposées à contenu granuleux plus ou moins dense (Fig.). Un tel aspect est visible aussi dans les glandes sexuelles après dégranulisation et succèderait alors aux « boules », confirmant les données histologiques.
Adénocyte
L’adénocyte sexuel est une longue cellule piriforme, accolée aux voisines par des faces sinueuses et convergeant avec ces dernières, au nombre total de 4 ou 5 par coupe transversale, vers une cavité centrale collabée très difficile à reconnaître.
Le pôle apical présente encore une invagination de l’ espace extracellulaire également collabée et réduite à un lacis formé par des microvilli enchevêtrées (Fig.)
Le cytoplasme sous-jacent contient de nombreux ribosomes et des microfilaments s’engageant dans les axes villositaires. Ses régions moyenne et basale contiennent des mitochondries à crêtes parallèles, de rares dictyosomes (Golgi), des ribosomes libres, des polysomes et surtout, de très nombreuses vésicules. Correspondant aux vacuoles de l’histologie, et très différentes des grains de sécrétion de Linyphiidae, elles sont subsphériques, de taille variable, plus ou moins confluentes et renferment parfois un matériel dispersé et peu contrasté.
Le petit noyau, souvent déformé par les vésicules adjacentes, contient un nucléole excentrique et des masses chromatiniennes de taille assez uniforme, tendant à s’accoler à l’enveloppe nucléaire.
Cellule intermédiaire
Elle est volumineuse, allongée, très irrégulière au contact des adénocytes entre lesquels s’insinuent ses longues digitations mais s’ordonne autour du canal excréteur en un «manchon» plus ou moins aplati.
Le noyau est volumineux, ovalaire et pourvu d’une chromatine en masses dispersées.
Le hyaloplasme est clair et très abondant. Il renferme quelques mitochondries, des polysomes épars , de petites vésicules à paroi mince contenant parfois un grain sphérique et surtout, des microtubules. Ces derniers sont nombreux et se groupent en faisceaux compacts parallèles aux canal excréteur, lui formant ainsi une sorte de «gaine».
La cellule intermédiaire est unie par des zonulae adhaerens, d’une part aux adénocytes (digitations), d’autre part à la cellule canalaire (extrémté opposée).
Appareil cuticulaire
Succincte chez Linyphia et Leptyphantes, son étude a été beaucoup plus poussée chez Leptoneta et montre dans leurs unités sexuelles un même aspect fondamental, retrouvé d’ailleurs dans les unités glandulaires classiques. Les canaux excréteurs sont entourés par des cellules canalaires.
Cellules canalaires
Cellule satellite de la microscopie photonique, chacun de ces éléments enveloppe le canal excréteur en se refermant sur lui-même et en formant un méso de plasmalemme par l’accolement de ses faces opposées. Il reste toutefois séparé du canal par une cavité extracellulaire où font saillie des microvillosités groupées en bouquets. Leur extrémité libre présente souvent une zone plus dense aux électrons (Fig.).
Le cytoplasme des cellules canalaires renferme un grand nombre de mitochondries longues et sinueuses, ainsi que des grains très osmiophiles.
Canal excréteur
Il est arrondi, régulier, montre une lumière béante et une paroi épaisse, formée par deux couches, interne et externe.
La première est un liséré osmiophile fin et sinueux, tandis qiue la seconde, beaucoup plus épaisse, montre une structure hétérogène, finement granuleuse avec des vermiculations. Toutes deux se raccordent à l’épicuticule tégumentaire après avoir formé un «bec» aigu, correspondant en coupe à la saillie papilliforme déjà signalée (histologie, M.E.B.).
Cellules canalaires
Elles forment aussi un «manchon» en se refermant sur elles-mêmes et en créant ainsi un méso, sans toutefois s’accoler partout aux conduits et en restant plus ou moins séparées par une étroite cavité extracellulaire.
Il y a deux cellules canalaires proximales chez Leptyphantes (probablement aussi chez Linyphia), la première succédant à la cellule intermédiaire qui lui est unie par une jonction annulaire, et des distales, en nombre plus ou moins grand selon la longueur du canal. Elles présentent des microvilli d’ailleurs peu visibles au-dessous de la cuticule, renferment un chondriome assez développé ainsi que de nombreux microtubules mais paraissent dépourvues de toute activité sécrétrice. Leur noyau est excentrique, allongé, aplati et contient de petites mottes chromatiniennes.
Par contre, il n’y en a qu’une seule dans le cas de Leptoneta microphthalma. Elle est trés allongée, également unie à la cellule intermédiaire par une jonction annulaire et détermine, par l’accolement localisé de ses deux faces et de leurs plasmalemmes un méso particulièrement long, net et sinueux, correspondant à la «densification» des coupes histologiques. La face interne libre est hérissée de microvillosités longues, irrégulières et enchevêtrées occupant la cavité extracellulaire.
Le noyau excentrique est allongé, plat et pourvu de petites mottes chromatiniennes.
Le cytoplasme étendu se singularise par son extrême richesse en vésicules sphériques, régulières, de taille assez variable, les plus petites portant des ribosomes sur leur face externe, et les plus grandes contenant fréquemment un matériel homogène, opaque aux électrons.
Canal excréteur
Son étude succincte chez Leptyphantes sanctivincentii montre qu’il est cylindrique, d’un diamètre à peu près constant sauf dans les troncs commns où il doit s’accroître sensiblement.. Sa paroi est dense, d’aspect homogène, lisse intérieurement, mamelonnée sur sa face externe, donc d’épaisseur irrégulière et constituée au moins par de l’ épicuticule (Fig.....). En fait, le canal excréteur n’a bien été étudié que dans le cas de Leptoneta microphthalma.
Prolongeant les cavités extracellulaires.de chaque unité anatomo-fonctionnelle, il est d’abord très petit, paraît collabé et a une paroi extrêmement mince, sinueuse, de sorte que ses coupes transversales ou obliques dessinent des figures osmiophiles plus ou moins complexes, comme «étoilées» (Fig.).Lorsqu’il passe de la cellule intermédiaire à celle du canal, sa paroi s’épaissit brusquement et forme ainsi un conduit plus opaque où la lumière, devenue bien visible, renferme un matériel assez dense. De plus, la gaine microtubulaire disparaît.
Le canal excréteur sexuel reste ensuite déprimé, rarement béant près de sa terminaison. Sa lumière paraît vide ou renferme un matériel peu abondant et d’opacité modérée aux électrons. Sa paroi comporte deux couches, interne et externe, analogues à celles des canaux excréteurs de glandes classiques . Ses rapports avec l’épicuticule tégumentaire sont également semblables.
Commentaires
Comparaison avec d'autres glandes
Sur le plan anatomique, la structure fine des unités constituant les glandes gnathocoxales classiques et sexuelles les diffèrencie sensiblement de celles des autres glandes anatomiquement définies.
Elle permet de leur reconnaître un modèle fondamental commun à trois étages : un étage proximal tubulo-acinoïde, comprenant plusieurs adénocytes, et leurs cavités extracellulaires ; un étage moyen formé par une cellule intermédiaire non sécrétrice dont la cavité fait suite aux précédentes ; un étage distal constitué par le canal excréteur et sa (ses) cellule(s) canalaire (s). Ce modèle évoque celui des glandes tégumentaires d’Opilions (Martens, 1973)[14], de Myriapodes (Nguyen Duy- Jacquemin, 1978 ; Juberthie-Jupeau, 1976)[15] - [16], de Crustacés (Juberthie-Jupeau & Crouau, 1977), d’Insectes Aptérygotes (Juberthie-Jupeau & Bareth, 1977) et de très nombreux Ptérygotes. Toutefois, les glandes gnathocoxales possèdent un nombre d’adénocytes beaucoup plus élevé, surtout chez Leptoneta.
En outre, elles sont totalement dépourvues des canalicules récepteurs en « filtre » ou « crible » (au sens de Pastells, 1968, et de Quennedey,1978) et de l’appareil terminal (end apparatus) qui les complète, aussi bien dans d’autres organes sécréteurs d’Araignées (glande clypéale, glande segmentaire rétrognathocoxale, glande labiosternale, glande rétrogonoporale…) que dans ceux d' Arthropodes d'ordres différents. Par leur structure composite très particulière, les glandes gnathocoxales ne peuvent donc être rattachées à la classe 3 des glandes épidermiques d’Insectes et autres Arthropodes, d’autant plus que chez Leptoneta la cellule canalaire sexuelle montre des signes d’activité sécrétoire très marquée, à peu près inconnus dans les autres ordres.Les grains de sécrétion naissent de l'appareil de Golgi et leur aspect variable, lié aux proportions respectives de leurs trois composants, correspond à différents degrés ou stades de maturation.
Chez Linyphia, les rapports étroits des grains avec le réticulum et leur disposition en « boules circonvoluées » uniformes s’oppose à cette complexité et à une origine golgienne, mais il ne s’agit peut-être là que d’un aspect également temporaire, impossible à cerner faute d’études plus complètes. Il n’est pas sans rappeler les « tourbillons » que Crossley & Waterhouse (1969) ont décrit dans l’osmeterium de certains Insectes Lépidoptères (chenilles de Papilio).
Fonctions présumées
Sur le plan fonctionnel, les glandes maxillaires propres aux mâles ont certainement un rôle lié au comportement sexuel comme dans le cas de la glande acronale (clypéale). Elles pourraient intervenir dans 3 fonctions qui ne s’excluent d’ailleurs pas mutuellement lors de la copulation et ses préliminaires, à savoir : une lubrification de l’embolus du bulbe pédipalpaire lorsque l’accouplement est prolongée et (ou) répété ; une obturation des voies génitales femelles assurant au mâle sa « priorité spermatique » ; une action attractive ou, inversement, inhibitrice sur la partenaire.
Lubrification du pédipalpe
Une fonction lubrificatrice du pédipalpe mâle (palpal lubrication des anglophones) paraît la plus vraisemblable. Divers auteurs ont en effet signalé qu’au cours de la copulation, le mâle de nombreuses Araignées introduit souvent ses palpes entre les chélicères et les pièces buccales comme pour les machonner (palpal chewing), humecter ou nettoyer, manœuvre observée notamment chez les Linyphiidae (Wiehle, Rovner) et chez certaines Araneidae Araneinae telles qu’Araniella cucurbitina (Blanke,1973).
Selon toutes probabilités, les glandes maxillaires mâles élaborent alors une substance qui recouvre l’organe copulateur, en particulier son bulbe et l’embolus, assure l’entretien extérieur de cet organe complexe ou du moins le lubrifie, facilitant ainsi son intromission rotative dans les voies génitales de la femelle.
Chez les Linyphiidae (Linyphiinae et Erigoninae), le développement des glandes gnathocoxales est tel qu’une sécrétion profuse doit inonder littéralement, avant leur insertion, les pièces chitineuses de bulbes complexes, plusieurs fois utilisés au cours de longs accouplements.
De même, chez les Araneinae à dimorphisme gnathocoxal les mâles peuvent s’accoupler plusieurs fois car l’intégrité de leurs emboli a été conservée et leur sécrétion maxillaire abondante les lubrifie avant chaque copulation.
Plusieurs arachnologistes (Peck et Whitcomb,1970 ; Rovner, Gering…) ayant décrit aussi une lubrification palpaire dans certaines familles (Clubionidae,Lycosidae,Agelenidae) dont les mâles semblent dépourvus de glandes maxillaires « sexuelles », il semblerait qu’ une humidification des bulbes puisse fort bien être assurée par des glandes salivaires normales ou classiques et constitue, de ce fait, un trait éthologique assez répandu chez les Araignées. L’apparition de structures génitales complexes n' aurait donc entrainé une différenciation de glandes lubrifiantes mâles spécialisées que dans deux familles apparentées (Linyphiidae, Erigoninae comprises ; Araneidae), chez les Leptonetidae, et peut être aussi dans d’autre groupes taxonomiques à explorer.
Fonction obturatrice
Bien que séduisante, une fonction obturatrice du gonopore femelle par la sécrétion gnathocoxale est moins assurée. Les bouchons d’accouplement (mating plugs en anglais) qu’elle pourrait constituer en se solidifiant ne paraît pas signalé chez les Linyphiidae, famille pourtant la mieux équipée en glandes sexuelles. En revanche, des bouchons ont été signalés chez les Salticidae, Clubionidae, Oxyopidae, Thomisidae et Theridiidae tous dépourvus, semble-t-il, des mêmes organes mâles.
Au sein de la denière famille, le cas des Argyrodes est particulièrement éloquent : la présence d’obturateurs génitaux spectaculaires chez la femelle contraste avec des glandes gnathocoxales réduites et identiques dans les deux sexes ; leur élaboration par une partie au moins de la glande pédipalpaire semble être la plus vraisemblable.
Action sur la femelle
Une action attractive ou inhibitrice sur la femelle impliquerait que la sécrétion maxillaire sexuelle est aussi de nature phéromonale. En effet, dans le cas au moins d’Araniella cucurbitina, le mâle enduit de sécrétion, non seulement les pédipalpes mais aussi ses pattes antérieures au cours du nettoyage (Blanke, 1973). La substance jouerait alors un rôle sémiochimique lors des attouchements inhibiteurs d’agressivité que les pattes exercent sur le prosome femelle pendant la cour à brève distance. L’existence de divers grains de sécrétion (Lepthyphantes) pourrait y traduire plusieurs composantes.
Intérêt systématique
Sur le plan systématique, le dimorphisme sexuel gnathocoxal dans les genres Leptoneta[4] - [5] - [6], Paraleptoneta [7] et même Sulcia (observation histologique non publiée) se présente comme un nouveau caractère familial d’intérêt majeur. Il a été d’ailleurs pris en compte par Brignoli (1979) dans son étude des Leptonetidae. Jusqu’alors, la diagnose de cette famille ne reposait que sur un les caractères définis par Fage (1913) et y incluait [null Telema tenella]. En fait, cette petite Araignée pyrénéenne ne montre pas de dimorphisme sexuel gnathocoxal mais possède d’autres caractères positifs remarquables (spermatophores, organe copulateur mâle, spermathèque de la femelle, sphérites intestinaux) permettant formellement de l’extraire des Leptonetidae pour la rattacher aux Telemidae.
L’existence d’un dimorphisme gnathocoxal avec des glandes sexuelles encore plus « exubérantes », comme « ectopiques », et souvent pourvues d’un système canalaire complexe est un argument de poids supplémentaire pour associer « Linyphies » et « Erigones » sensu lato dans une seule et même famille : les Linyphiidae. Soulignant toutes les difficultés d’une limitation taxonomique dans cette famille, Lehtinen et Saaristo (1970) avaient d’ailleurs proposé un examen combiné de divers critères anatomiques et des caractères cytologiques. Malgré des différences leur conférant un statut de sous-familles, Linyphiinae et Erigoninae, ces Araignées n’en sont pas moins étroitement apparentées, d’autant plus que leur prosoma contient souvent aussi des [null glandes acronales]. Une subdivision bifurquée en deux familles distinctes, Linyphiidae et Erigonidae, est donc bien impossible (Lehtinen, 1975).
En ce qui concerne l’immense groupement des Araneidae, sa sous-famille des Araneinae devrait faire l’objet d’une révision taxonomique complémentaire fondée cette fois, et entre autres critères, sur l’anatomie des glandes gnathocoxales ou maxillaires et leur rapport, lorsqu’elle existe, avec une coiffe embolique dans le bulbe copulateur.
Intérêt phylogénique
Sur le plan phylogénique, et bien qu’il n’ait guère été pris en compte par les auteurs, le dimorphisme sexuel gnathocoxal justifie pleinement qu’ Araneidae et Linyphiidae soient réunies dans la même super-famille des Araneoidea (ex Argiopiformia ou Argiopidea). Selon Lehtinen (1975), les Linyphiidae y descendraient d’ailleurs directement de la première famille. Il insiste par ailleurs sur les difficultés d’une limitation taxonomique chez les Linyphiidae et en propose même un examen combiné du colulus, de la sclérification abdominale, des trichobothries, du pédipalpe femelle et, ce qui est à retenir ici, des caractères cytologiques. Le dimorphisme des Leptonetidae n’autorise aucun rapprochement avec la superfamille précédente et semble les isoler au sein des Haplogynes.
Anatomie comparée
Le dimorphisme sexuel salivaire est une rareté anatomique se retrouvant, en dehors des trois familles d’ Araignées qu’il concerne, dans l’ordre des Insectes Mécoptères et celui des Hétéroptères Lygaeidae. Chez les Mécoptères, des Panorpidae telles que Panorpa communis et peut-être aussi les Choristidae, possèdent en effet des glandes salivaires ou labiales rudimentaires chez la femelle mais énormes chez le mâle où elles s’étendent jusqu’au sixième segment abdominal (Grell, 1938). Elles interviennent dans la parade nuptiale lorsque le mâle régurgite de la salive que la femelle ingère ensuite (Mercier, 1915). Chez le Lygaeide Stilbocoris natalensis le mâle possède un lobe salivaire postérieur très allongé et en injecte la sécrétion dans une graine de Moracée qu’il offre ensuite à la femelle (Carayon, 1964). Un tel don salivaire entre partenaires sexuels n’a jamais été observé chez les Araignées où les seules sécrétions mâles qui soient absorbées, ou du moins contactées par la femelle, sont émises au niveau du bandeau ou clypeus par la glande clypéale de Theridiidae Argyrodes et d'organes glandulaires apparentés chez les Linyphiidae (Erigoninae, quelques Linyphiinae des genres Bolyphantes, Tapinopa).
Bibliographie
- A. Lopez, avec R. Legendre, Variations morphologiques sexuelles des glandes gnathocoxales chez les Araneidae (Araneae), C.R. Acad. Sci., Paris, 279, p., 1974, p. 1769-1771.
- A. Lopez, Contribution à l’étude des caractères sexuels somatiques chez les mâles des Aranéides, Thèse de Doctorat d' Etat es Sciences, Université des Sciences et Techniques du Languedoc (USTL), Montpellier. 150 pp (14 planches dont 4 en couleurs), A.O. CNRS 1974.
- A. Lopez, avec M. Emerit, Le dimorphisme sexuel gnathocoxal de Leptoneta microphthalma Simon (Araneae, Leptonetidae), Rev. Arachnol., 2 (1), 1978, p. 1-15.
- A. Lopez, avec L. Juberthie-Jupeau et C. Ribera, Les glandes gnathocoxales des Leptoneta (Araneae, Leptonetidae). Structure, ultrastructure et intérêt systématique, C.R.Ve Coll. Arachnol. express. franç., Barcelone, 1979, p. 163-178.
- A. Lopez, Le dimorphisme sexuel prosomatique de Walckenaera acuminata Blackwall, 1833 (Araneae, Erigonidae), Bull.Soc.Zool.France, 106, no 2, 1981, p. 125-132.
- A. Lopez, Coiffe embolique et dimorphisme sexuel maxillaire chez les Araneidae (Araneae), Bull. Soc.Et.Sci.nat, Béziers, 11, 52, 1986, p. 4-11.
- A. Lopez, avec M. Emerit, Seminario de Anatomia : Analogies and homologies in the sensory and glandular systems of the Arachnida, Actas X Congr. Int. Aracnol, Jaca / Espana, II, 1986, p. 25-40.
- A. Lopez, Glandular Aspects of Sexual Biology in Nentwig, W., ed. « Ecophysiology of Spiders », Springer-Verlag, Berlin Heidelberg New-york London Paris Tokyo, 1987, p. 121-132.
- A. Lopez, avec L. Juberthie-Jupeau, The gnathocoxal glands of the cave spider Leptyphantes sanctivincentii (Simon) (Araneae : Linyphiidae) : structure and ultrastructure, Mém.Biopéol., XVI, 1989, p. 233-239.
- A. Lopez, Les caractères du dimorphisme sexuel chez les mâles d’Araignées : revue, données nouvelles et classification, Bull. Soc. Archéol. Scient. Litt. Béziers, 7e ser., I, 1986, p. 43-56.
- A. Lopez, avec L. Juberthie-Jupeau, 44Sexual dimorphism of gnathocoxal glands of the Spider Leptyphantes sanctivincentii, Tissue and cell, 23 (3), 1991, p. 423-426.
- R. Legendre, Ann.Univ.Saraviensis, 2, 1953, p. 305-333.
- A. Lopez, Quelques points d’histologie comparée prosomatique chez les Oecobiidae et les Hersiliidae (Araneae), Rev. Arachnol., 5 (4), 1984, p. 343-354.
- A. Lopez, Some observations on the internal anatomy of Diguetia canities (McCook, 1890) (Araneae, Diguetidae), J.Arachnol.(USA), 11, 1984, p. 377-384.
V
Notes et références
- A. Lopez, « Contribution à l’étude des caractères sexuels somatiques chez les mâles des Aranéides. », Thèse de Doctorat d'État es Sciences. Université des Sciences et Techniques du Languedoc (USTL), Montpellier.150 pp (14 planches dont 4 en couleurs), A.O. CNRS 12397.,
- A. Lopez, avec R.Legendre, « Variations morphologiques sexuelles des glandes gnathocoxales chez les Araneidae (Araneae) », C.R. Acad. Sci. Paris, 279, p. 1769-1771,
- A. Lopez, avec L. Juberthie-Jupeau et M.K. Stowe, « L’appareil séricigène de Kaira alba (Hentz) », Mem.Soc.roy. belge d’Entomologie, 33, p. 119-128.,
- A. Lopez, avec R .Mazel, F. Marcou, J. Delabie et J.Fauré, « Recherches sur la Faune cavernicole de l’arrondissement Béziers-Saint Pons : deuxième note (Arachnides, Insectes) », Bull.Soc.Et.Sci.nat. Béziers, 6, 47, p. 4-37,
- A. Lopez, avec M. Emerit, « Le dimorphisme sexuel gnathocoxal de Leptoneta microphthalma Simon (Araneae, Leptonetidae). Rev. Arachnol., (1), p. 1-15 », Rev. Arachnol., (1), p. 1-15,
- A. Lopez, avec L. Juberthie-Jupeau et C. Ribera, « Les glandes gnathocoxales des Leptoneta (Araneae, Leptonetidae). Structure, ultrastructure et intérêt systématique. », C.R.Ve Coll. Arachnol. express. franç., Barcelona, 1979, p. 163-178,
- A. Lopez, avec C. Ribera, « Résultats d’une campagne biospéologique en Tunisie et description d’une espèce nouvelle de Leptonetidae (Araneae) : Paraleptoneta bellesi », Rev. Arachnol., 4, p. 57-64.,
- A. Lopez, « Les caractères du dimorphisme sexuel chez les mâles d’Araignées : revue, données nouvelles et classification », Bull. Soc. Archéol. Scient. Litt. Béziers, 7e ser., I, p. 43-56,
- A. Lopez, « Coiffe embolique et dimorphisme sexuel maxillaire chez les Araneidae (Araneae) », Bull. Soc.Et.Sci.nat. Béziers, 11, 52, p. 4-11,
- A. Lopez, avec M. Emerit, « Seminario de Anatomia : Analogies and homologies in the sensory and glandular systems of the Arachnida », Actas X Congr. Int. Aracnol. Jaca / Espana, II, p. 25-40.,
- A. Lopez, avec C. Ribera, S. Salines, J. Guilhaumon et F. Marcou, « Recherches sur la Faune cavernicole de l’arrondissement Béziers-Saint Pons : note préliminaire (Aranéides, Crustacés) », Bull. Soc.Et.Sci.nat. Béziers, 5, 46, p. 26-44,
- (en) A. Lopez, avec L. Juberthie-Jupeau, « The gnathocoxal glands of the cave spider Leptyphantes sanctivincentii (Simon)(Araneae : Linyphiidae) : structure and ultrastructure. », Mém.Biopéol., XVI, p. 233-239.,
- (en) A. Lopez, avec L. Juberthie-Jupeau, « Sexual dimorphism of gnathocoxal glands of the Spider Leptyphantes sanctivincentii. », Tissue and cell, 23 (3), p. 423-426.,
- (de) Martens,J., « Feinstruktur der Cheliceren-Drüse von Nemastoma dentigerum Canestrini (Opiliones, Nemastomatidae). », Z. Zellforsch. 136, 121-137 (1973),
- Nguyen Duy-Jacquemin, M., « Ultrastructure des glandes du tentorium (glandes 'cerebrales') de Polyxenus lagurus(myriapode: diplopode: penicillate). », Annales des Sciences naturelles, Zoologie et Biologie Animale, 20(4): 339-356.,
- (en) Juberthie-Jupeau, L., « Fine structure of postgonopodial glands of a myriapod Glomeris marginata (Villers). », Tissue and Cell. 8 (2), 1976, p. 293-304.,