Glande labiosternale
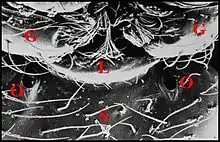
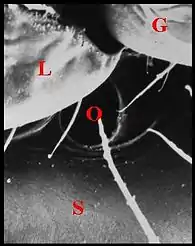
La glande labiosternale est un organe prosomatique qui caractérise la famille des Theridiosomatidae. Situé au-dessous du cerveau dans la partie ventrale du prosome ou céphalothorax, il s'ouvre extérieurement sur le sternum par un pore que précède le labium (Fig.1 à 4)
Introduction
La glande labiosternale est un organe sécréteur exocrine qui semble propre aux seuls Theridiosomatidae, petite famille d’ Araignées “ Labidognathes ”, pour la plupart tropicales, se rattachant aux Araneoidea les plus primitives et dont la biologie parait encore mal connue[1].
Dans leurs études morphologiques de Wendilgarda américaines, Archer (1953) et Brignoli (1972) ont signalé l’existence de petites “ fossettes ” sternales (“sternal pits ”) rapprochées du labium, retrouvées plus tard par Wunderlich (1980 : “ sternal-organ ”)[2] chez d’autres genres de Theridiosomatidae (Theridiosoma, Ogulnius, Epeirotypus) et qu’il considère comme une autapomorphie familiale.
Ultérieurement, Coddington (1988) les signale encore comme caractères de diagnostic dans sa monographie sur tous les genres connus de Theridiosomatidae[1]. Wunderlich a précisé, que les “ organes sternaux ” ont l’ aspect d’ invaginations sacciformes, de nature

glandulaire, mais il s’est uniquement basé sur l’examen superficiel et grossier de préparations éclaircies, sans exploration histologique, la seule valable[2].
Les premières études histologiques par coupes sériées (C.H.) et ultrastructurales (microscopie électronique à balayage, M.E.B. et à transmission, M.E.T.) de l’ “organe sternal” ont été effectuées par A.Lopez & al (1983,1988,1993[3] - [4] - [5]). Elles apportent la preuve formelle qu’il est de nature glandulaire et s’ouvre bien à l’extérieur par la fossette (“pit”). Ils ont également proposé d’appeler cette dernière “ pore labio-sternal ” et la structure qui y débouche, “ organe labio-sternal ”, ces noms composés exprimant mieux leur position très antérieure au contact du labium.
Le matériel étudié se composait de 3 Theridiosomatidae néotropicaux : Wendilgarda mustelina arnouxi (Guadeloupe), Theridiosoma sp. (Martinique) et Naatlo splendida ex Theridiosoma splendidum de Guyane française.
Organe labio-sternal
Pore labio-sternal
Vu au microscope électronique à balayage (M.E.B.), il se présente comme un orifice régulier situé sur le sternum au contact de son bord antérieur et de l’extrémité du labium, donc de la suture labio-sternale, Il est régulier, ovalaire et bordé d’une petite margelle postérieure chez Wendilgarda mustelina arnouxi (Fig.1,2), à peu près circulaire et de niveau avec la surface du tégument chez Theridiosoma sp, de Martinique (Fig.3), ouvert obliquement en bas, en avant et un peu en dedans, et mesurant de 10 à 20 µm de diamètre.
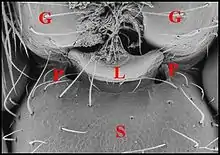
Cet aspect se retrouve chez d’autres Theridiosomatidae tels que Plato juberthiei de Guyane (Fig.4) et Ogulnius hayoti de Martinique.
Structure histologique.
L’organe s’abouchant au pore est pair, symétrique, paramédian, superficiel et repose sur le tégument sternal au voisinage immédiat du labium. Recouvert par la masse nerveuse sous-œsophagienne, il est constitué par un massif glandulaire et une poche réceptrice commune (Fig.5 à 8). Ainsi que l’indiquait Wunderlich d’après ses préparations éclaircies[2], cette poche est un “ sac ” s’ouvrant extérieurement au niveau du pore labio-
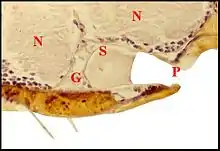
sternal, allongé (L = 90 à 100µm), plus large dans sa moitié postérieure (l = 60 à 70 µm) que dans l’antérieure (l = 40 µm), donc ovoïde ou piriforme (Fig.5,6) et orienté de telle sorte que son grand axe est à peu près horizontal, légèrement oblique en avant et un peu en dedans. Sa paroi est formée par une assise épidermique fine, bien visible seulement lorsqu’elle contient un pigment noir et surtout, par de la cuticule. Cette dernière, très mince au niveau du fond ou globalement chez Naatlo (2 µm), s’épaissit progressivement dans la partie antérieure (Wendilgarda) où elle atteint 4 µm et se raccorde à la chitine sterno-labiale (10 µm) sur le pourtour du pore (Fig.). Ainsi se
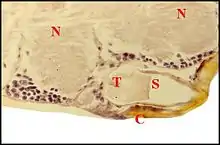
présente-t-elle comme une invagination en profond récessus du tégument et repose sur ce dernier par sa face ventrale sans lui adhérer. La cavité ou lumière de la poche renferme un matériel amorphe éosinophile en boules et masses irrégulières. Chez Wendilgarda (Fig.), il englobe de curieuses saillies pariétales, sorte de “ tigettes ” cuticulaires se détachant sur le pourtour du fond, longues en moyenne de 15 µm, bi ou trifurquées à leur extrémité libre et s’y terminant en pointes plus ou moins divergentes (Fig.6 à 8). Elles sont remplacées par de simples “ dentelures ” postérieures chez Naatlo. Le massif glandulaire
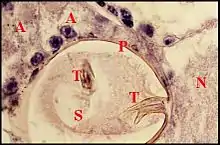
s’inscrit toujours dans une loge en triangle, haute d’environ 30 µm, que délimitent le pôle postérieur de la poche, les ganglions sous-œsophagiens et le tégument sternal. Ce massif est très compact chez Wendilgarda et Naatlo, ne dépassant pas vers l’arrière le niveau du ganglion de P II. Par contre, il est moins dense chez Theridiosoma, y adoptant une disposition en chapelet qui atteint le ganglion de P III. Il se compose de cellules ayant un aspect sécréteur, donc d'adénocytes, et de canalicules excréteurs flanqués par des cellules “ satellites ”. Les adénocytes sont volumineux (30 µm), oblongs, pourvus d’un
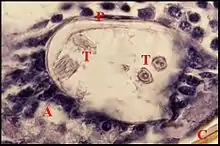
noyau arrondi vésiculeux (8 à 10 µm), nettement nucléolé ; leur cytoplasme est basophile en périphérie et présente une zone centrale éosinophile, striée, de forme ovalaire, évoquant un “ réservoir ” où débute un très grêle canalicule également coloré par l’éosine. Les cellules “ satellites ” siègent entre les adénocytes et la paroi de la poche, ont un petit noyau allongé (4 µm), à chromatine abondante, un cytoplasme pâle peu visible et entourent les canalicules venant de se dégager des adénocytes. Ces conduits sont grêles, tortueux, convergent vers la paroi de la poche et la traversent en une zone limitée de son pôle postérieur, au niveau des dentelures.
Ultrastructure
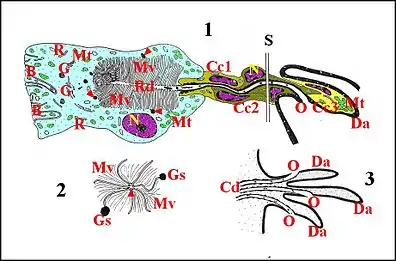
L’étude ultrastructurale chez Naatlo et Wendilgarda (Lopez, 1988, 1993[4] - [5]) montre que les cellules et les canaux sont bien réunis en unités glandulaires fonctionnelles toutes semblables (Schémas 1 et 2) dont la sécrétion est reçue par la poche collectrice. Cette dernière et l’ensemble de tous les canaux qui y aboutissent, récepteurs inclus, constituent un appareil cuticulaire global. Chez les deux espèces étudiées, l'unité glandulaire comporte une cellule sécrétante ou adénocyte et la partie de l'appareil cuticulaire qui le dessert, soit un canalicule récepteur, un canalicule excréteur ou conducteur et des cellules canaliculaires (Schémas 1 et 2).
Adénocyte
Il se présente comme une grosse cellule pyramidale.Son pôle externe ou basal, au contact du sinus hémolymphatique, montre quelques invaginations de la membrane (Wendilgarda)(Schéma 1) ou est régulièrement arrondi, sans indentations particulières (Naatlo)(Schéma 2) En revanche, son pôle apical est caractérisé par une invagination de l’espace extracellulaire en “ cul de sac ” ou “ doigt de gant ”, occupant le grand axe adénocytaire, légèrement
flexueuse et renferme un canalicule récepteur en position centrale. Cette invagination est bordée par des microvilli convergeant vers le canalicule récepteur, très nombreuses, longues en moyenne de 3 µm et remarquables par leur aspect très particulier. Aplaties en lamelles, elles se présentent comme des expansions foliacées beaucoup plus larges (1 µm) à la base qu’au sommet qui s’effile régulièrement en cône allongé. Elles ont ainsi un contour à peu près triangulaire, parfois cordiforme ou en “ as de pique ” lorsqu’il existe un léger pincement au-dessus de leur base (Wendilgarda) (Schéma 1 : 2). En outre, ces microvillosités ne sont pas planes mais sinueuses, et plus ou moins incurvées sur leurs deux axes. Elles s’appliquent enfin étroitement les unes contre les autres en s’imbriquant (Schémas 1,2 ; Fig.) et ne ménagent que des espaces virtuels ou que souligne un matériel osmiophile très peu abondant. Cette juxtaposition dense des microvilli crée des images très particulières dues à l’accolement : “ nids d’abeille ” lorsqu’elles sont coupées transversalement ; bandes transversales grenues équidistantes ou festons de zonation régulière (Fig.) lorsque leurs coupes sont obliques. Les mêmes microvillosités renferment des filaments intermédiaires (Wendilgarda), des microtubules longitudinaux (Naatlo) s’étendant de la base à l’apex où ils se disposent en couronne, et, dans ce même apex, une petite densification terminale.Le noyau siège en général dans la partie moyenne de l’adénocyte. Il est volumineux, clair, arrondi ou ovoïde et contient un nucléole réticulé excentrique. Sa chromatine est abondante, dispersée dans le nucléoplasme et forme aussi de petites mottes marginales. L’enveloppe nucléaire est en nette continuité avec le réticulum endoplasmique. Ce dernier est granulaire ou rugueux. Chez Wendilgarda, il est formé par de petits sacs variqueux, siégeant surtout près de la cavité extracellulaire et en périphérie, tandis que chez Naatlo, il paraît plus abondant et se compose de cisternae allongées, planes ou incurvées, formant par empilement un ergastoplasme développé, surtout dans la périphérie de l’adénocyte qui leur doit sa basophilie. Le chondriome est également remarquable par son abondance. Il se compose de mitochondries volumineuses, à matrice claire et crêtes sinueuses, réparties sans ordre apparent, très plastiques, souvent accolées en amas compacts et alors déformées par compression réciproque.De même, l’appareil de Golgi ou complexe golgien est très développé, du moins chez Wendilgarda. Il réunit des dictyosomes nombreux, petits, localisés près de la cavité extracellulaire, constitués chacun par un empilement de 3 à 5 saccules plus ou moins dilatés, présentant une face “cis” (proximale ou de formation) en rapport avec le réticulum endoplasmique et une face “trans” (de sortie ou de maturation) orientant sa concavité vers l’espace extracellulaire. Par cette face et les bords de ses saccules, chaque dictyosome bourgeonne un essaim de vésicules golgiennes recouvertes (réseau transgolgien), qui grossissent progressivement et donnent ainsi naissance aux grains de sécrétion.Ces grains sont arrondis ou anguleux, limités par une membrane et contiennent un matériel opaque, d’abord finement grenu, ensuite homogène et très osmiophile. Ils gagnent la base des replis microvillositaires, y émettent de petites protubérances s’abouchant dans les interstices et libèrent ainsi leur contenu qui s’insinue entre les microvilli jusqu’ au canalicule récepteur. Les autres organites subcellulaires sont de petites vésicules d’endocytose (pinocytose) entre les microvilli, des endosomes rejoints par les précédentes, des ribosomes libres, des microtubules pouvant s’engager dans les microvilli, des microfilaments qui y pénètrent aussi et des lysosomes secondaires, sans localisation précise, plus ou moins anguleux et à contenu membranaire hétérogène.
Appareil cuticulaire individuel
Drainant et emmagasinant la sécrétion de chaque adénocyte, il est formé par l’ensemble des canalicules récepteur et conducteur, ce dernier, qu'entourent des cellules canaliculaires, jusqu'à sa terminaison (orifice) dans la poche collectrice.
Canaux
Le canalicule récepteur est entièrement logé dans la cavité extracellulaire de l’adénocyte et en forme l’axe (Schémas, Fig.). Il présente une lumière très étroite, aplatie (0,3 µm en moyenne) et une paroi formée par de l’épicuticule externe, opaque aux électrons, très mince (10 nm), régulière, lisse sur ses deux faces, paraissant compacte et homogène chez Naatlo (Schéma 2), montrant en fait chez Wendilgarda deux couches discontinues lui donnant un aspect fenestré et s’interrompant peut-être aussi vers l’extrémité distale (Schéma 1-1). À ce niveau, le canalicule semble s’ouvrir dans la cavité extracellulaire, relativement spacieuse et contenant du matériel grenu. Partout ailleurs, le canalicule est en contact avec les apex microvillositaires qui s’accolent à lui. Il contient un matériel dispersé et finement granuleux ou plus dense, homogène, très osmiophile semblant mouler la lumière.
Le canalicule conducteur est beaucoup plus long que le précédent, lui fait suite au niveau de l’apex adénocytaire, décrit des sinuosités plus ou moins parallèles à la poche collectrice (Fig.), gagne enfin la paroi de cette dernière et s’y ouvre par un pore excréteur. Il présente une lumière arrondie (D = 0,5 µm), vide ou à contenu osmiopohile granuleux, et une paroi ininterrompue formée par deux couches d’épicuticule, l’une interne mince, régulière, lisse du côté de la lumière, l’autre externe plus dense, épaissie en mamelons irréguliers, surtout dans la partie proximale où ils forment des masses polylobées.
Cellules canaliculaires
Elles enveloppent le canalicule conducteur depuis sa jonction avec le récepteur jusqu'à la poche collectrice commune.
Il semble n’y en avoir que deux, proximale et distale, chez Naatlo splendida (Schéma 2), cas le plus simple, et un ensemble plus complexe chez Wendilgarda mustelina arnouxi (Schéma 1) où seules, la première et la dernière peuvent être encore individualisées. Elles sont allongées, aplaties et s’enroulent autour du canalicule excréteur ou conducteur, leurs faces accolées formant un méso plus ou moins sinueux, clos par une zonula adherens. Le noyau est également allongé et déprimé, irrégulier, anguleux et renferme une chromatine compacte se condensant en grosses mottes ou blocs marginaux. Le cytoplasme, clair et peu abondant, renferme des polysomes, quelques mitochondries, des microtubules se disposant en paquets longitudinaux et ne présente jamais les stigmates d’une activité sécrétoire. La cellule proximale s’engage dans la cavité extracellulaire de l’adénocyte qui l’entoure d’une collerette cytoplasmique et qu’elle obture comme un bouchon au-dessus des microvilli. (Schémas 1,2). Elle se dégage ensuite de cet adénocyte en entourant la partie initiale du canalicule conducteur, se dirige avec lui vers la poche collectrice en s’insinuant parfois entre d’autres cellules sécrétrices et est remplacée, soit par une succession des cellules “intermédiaires” identiques (Wendilgarda) (Schéma 1-1 S) soit directement par la cellule distale (Naatlo) (Schéma 2). Cette dernière court sous la cuticule de la poche, dépourvue d’épiderme à ce niveau, et y entoure la partie terminale du canalicule conducteur jusqu’à l'orifice excréteur terminal (Fig.17, Schéma 1-3). Dans le cas de Wendilgarda, la cellule toute distale est particulièrement allongée, pénètre avec le canalicule conducteur dans une pointe de "tigette" ("digitation") où son cytoplasme, remontant bien au-delà de l'orifice excréteur (Schéma 1-1), s'y moule étroitement ; il renferme des vésicules de réticulum, des microtubules longitudinaux et des mitochondries de forme parfois complexe (Schéma 1-2, Fig.17).
Poche collectrice
Sa paroi est bien formée par un revêtement chitineux et par une assise épidermique interrompue dans la zone où aboutissent les canalicules.Le revêtement chitineux montre une couche intérieure d’épicuticule (épicuticule externe et interne) en continuité avec la paroi des canaux au niveau de leurs pores excréteurs individuels (Schéma 2), et une couche extérieure d’épicuticule, plus épaisse, montrant des canaux-poraires (pores-canaux), stratifiée en unités laminaires, s’interrompant brusquement au niveau des mêmes orifices. Elles sont toutes deux en continuité avec celles du tégument ventral sur le pourtour du pore labio-sternal. L’endocuticule tégumentaire qui est d’ailleurs absente de toute la poche, s’y termine en un “coin effilé”.
Dans le cas simple de Naatlo (Schéma 2), l’épicuticule interne s’épaissit irrégulièrement entre les pores canalaires, formant des crêtes aiguës ou émoussées qui correspondent aux dentelures des coupes histologiques.
Dans celui, plus complexe de Wendilgarda (Schéma 1), la paroi de la poche s’infléchit brusquement dans les projections très saillantes qui avaient l’aspect de “tigettes” en microscopie photonique mais que nous pouvons qualifier ici “apophyses”, un peu incurvées, effectivement ("pointes") à leur extrémité libre et présentant une section transversale oblongue. Comme le reste de la paroi, ces apophyses, effectivement bi- ou tri-furquées en digitations à leur extrémité libre (Schéma 1-3), sont formées par de l’épicuticule et une exocuticule plus mince qu’ailleurs, assez riche en canaux poraires renfermant des languettes cytoplasmiques. Leur axe est occupé par des cellules épidermiques, par la cellule distale du canalicule conducteur (Schéma1-1)et la terminaison de ce dernier, ouvert en entonnoir sur le tiers inférieur de l’apophyse, au niveau de sa concavité (Schéma 1-3).
Le contenu de la poche est un matériel sécrétoire opaque aux électrons, intensément osmiophile, amorphe, adhérant chez Wendilgarda à la paroi et ses apophyses en une pellicule discontinue. Il forme surtout des masses plus ou moins volumineuses et coalescentes, à contours concaves chez Naatlo ou sphériques, homogènes ou criblées de lacunes arrondies, montrant, chez Wendilgarda, une “écorce” périphérique.
Cellules épidermiques
Peu nombreuses, elles se logent entre la cuticule de la poche et les adénocytes, s’engrènent par leurs faces latérales, entourent aussi les cellules canalaires, leur sont unies par de petites jonctions subapicales (zonula adherens) et , dans le cas de Wendilgarda, pénètrent dans les axes des apophyses, y accompagnant le canal et sa cellule distale. Chaque cellule épidermique montre un noyau aplati, lenticulaire, à chromatine dense formant des blocs irréguliers comme dans les cellules canalaires. Son cytoplasme contient des ribosomes et surtout, des grains pigmentaires sphériques très osmiophiles, denses et homogènes. Le pôle apical sous-cuticulaire est garni de microvillosités courtes et en petit nombre.
Commentaires
Anatomie
Sur le plan anatomique, l’histologie est assez uniforme dans les trois genres étudiés (Wendilgarda, Theridiosoma, Naatlo) qui diffèrent seulement par la disposition plus ou moins compacte de leur massif glandulaire et la structure pariétale de la poche collectrice, se singularisant chez Wendilgarda par ses curieuses "tigettes", apophyses de la M.E.T..
Il en est de même pour la structure fine des unités entrant dans la constitution de l’organe labio-sternal et qui permettent de rattacher ses adénocytes à la classe 3 des cellules glandulaires épidermiques d’Arthropodes (Noirot & Quennedey, 1974). Par leur groupement et le fait qu'elles déversent la sécrétion dans une poche collectrice commune, l’organe entier peut être considéré comme “anatomiquement défini” (Noirot & Quennedey, 1974).
Les microvillosités ont une forme très originale non observée dans les autres adénocytes d’ Araignées ([null spermathèque] de Telema tenella comprise) :) en lames trapézoïdales d’épaisseur constante et jusqu’à 10 fois plus larges à la base qu’au sommet chez Naatlo ; en expansions foliacées triangulaires, parfois cordiformes, chez Wendilgarda. Elles évoquent celles de l'adénocyte rétrogonoporal par leur nombre très élevé, leur juxtaposition étroite et le fait qu’elles semblent oblitérer la cavité extracellulaire. En revanche, elles diffèrent des replis apicaux de la spermathèque chez Telema tenella (Lopez, 1983) ainsi d'ailleurs chez les Insectes que des microlamelles, également apicales des Bathysciinae souterrains (Juberthie-Jupeau & Cazals, 1983). Mais c’est surtout par le développement remarquable de l’appareil cuticulaire et sa poche sacciforme que l’organe labiosternal diffère de toutes les autres glandes prosomatiques d’ Araignées. Une telle séparation du réservoir et des cellules sécrétrices qui lui sont annexées se rencontre en revanche fréquemment chez les Insectes : glande métapleurale des Formicidae (Hölldobler & Engel-Siegel, 1984), glandes défensives des Coléoptères Ténébrionidae (Eisner & al., 1964) ou glandes antennaires des Pselaphidae (De Marzo & Vit., 1983). Néanmoins, la glande labiosternale présente un état de différenciation moins poussé que chez ces Insectes car sa poche est simple, non compartimentée et les unités glandulaires , dont chacune ne comporte qu'un adénocyte, appartiennent toutes à un seul et même type. Elle est donc loin d'atteindre la complexité des glandes défensives d' Hétéroptères et surtout, de la glande sternale des Rhinotermitidae (Quennedey, 1978).
Homologies
Sur le plan homologique, la glande labio-sternale pourrait être considérée comme une variation des glandes segmentaires d' Aranéomorphes, sur un mode qui parait propre aux Theridiosomatidae. Tout se passe comme si le recessus collecteur et son ouverture, qui siègent normalement sur la coxa des P I ou sur la gnathocoxe des autres Araignées, se soient déplacés vers la ligne médiane, en plein sternum et plus ou moins près du labium, chez les Theridiosomatidae.
Fonction
Sur le plan fonctionnel, la présence d’un appareil terminal est en faveur de la production d’un sémio-chimique, phéromone ou allomone, comme dans d’autres glandes tégumentaires d’Araignées. Cette sécrétion doit avoir une composante glycoproteique (grand développement du Golgi, positivité de l'adénocyte à l'A.P.S.). Elle met certainement en jeu des phénomènes énergétiques intenses, un métabolisme élevé (richesse du chondriome) et des échanges très actifs que traduit la conformation particulière des microvillosités, ces dernières accroissant considérablement la surface apicale de l'adénocyte. Il est peu probable que cette même sécrétion soit modifiée dans le canalicule conducteur car sa paroi est ininterrompue et les cellules-enveloppes ne présentent aucune activité élaboratrice. Sa résorption dans la poche pourrait expliquer l’aspect très variable du matériel qui s’y est déposé. L’attraction sexuelle ne peut être invoquée car les adultes des deux sexes et les immatures sont tous pourvus de glandes labio-sternales apparemment identiques.
En revanche, la sécrétion, si elle est phéromonale, pourrait intervenir dans la reconnaissance intra-spécifique, rôle déjà envisagé pour les glandes segmentaires surtout rétrognathocoxales, ou, s’il s’agit d’une allomone, dans l’attraction chimique des proies. Ces dernières, surtout des Micro-diptères Nématocères [1], pourraient être alors saisies directement par l’Araignée lorsque sa toile est rudimentaire (Wendilgarda) ou s’engluer dans son piège orbiculaire à détente (Naatlo, Theridiosoma).
Liens externes
www.european-arachnology.org/esa/wp-content/uploads/2015/08/067-076_Lopez.pdf
Bibliographie
- A.Lopez, avec M.Emerit, 1983 - Wendilgarda mustelina arnouxi n.sp. et la glande labio-sternale des Theridiosomatidae (Araneae). Mem.Biospéol., 12, p. 67-76.
- A. Lopez, L. Juberthie-Jupeau, « Structure et ultrastructure de la glande labio-sternale chez Theridiosoma splendidum (Tacz.)(Araneae : Theridiosomatidae) », XI European Arachnologisches Colloquium, , p. 332-339 (lire en ligne)
- A.Lopez, avec L. Juberthie-Jupeau, 1993 – Ultrastructure des glandes labio-sternales et péri-buccales chez Wendilgarda mustelina arnouxi Lopez & Emerit (Araneae, Theriiosomatidae). Rev. Arachnol., 10 (4), p. 75-92.
Notes et références
- (en) Coddington, « The genera of the spider family Theridiosomatidae », Smithsonian Contributions to Zoology, no 422, , p. 1-96 (DOI 10.5479/si.00810282.422)
- (de) J. Wunderlich, « Sternal-Organe der Theridiosomatidae - Eine bisher übersehene Autapomorphie (Arach. : Araneae) », Verh. naturwiss, no 23, , p. 255-257.
- A.Lopez, avec M.Emerit, « - Wendilgarda mustelina arnouxi n.sp. et la glande labio-sternale des Theridiosomatidae (Araneae). », Mem.Biospéol., 12, p. 67-76.,
- Lopez,A. avec L. Juberthie-Jupeau, « - « Structure et ultrastructure de la glande labio-sternale chez Theridiosoma splendidum (Tacz.)(Araneae : Theridiosomatidae) », XI European Arachnologisches Colloquium, septembre 1988, p. 332-339 (lire en ligne) », XI European Arachnologisches Colloquium, septembre 1988, p. 332-339 (lire en ligne),
- A.Lopez, avec L. Juberthie-Jupeau, « – Ultrastructure des glandes labio-sternales et péri-buccales chez Wendilgarda mustelina arnouxi Lopez & Emerit (Araneae, Theriiosomatidae). », Rev. Arachnol., 10 (4), p. 75-92.,