Fluorure de mercure(I)
Le fluorure de mercure(I), ou fluorure mercureux, est un composé chimique de formule Hg2F2. Il s'agit d'un solide jaune à cristaux cubiques, qui vire au noir lorsqu'il est exposé à la lumière[3]. La molécule Hg2F2 est linéaire, à l'instar des autres composés mercureux de la forme X–Hg–Hg–X. La liaison Hg–Hg a ici une longueur de 251 pm (contre 300 pm dans le mercure métallique) tandis que les liaisons Hg–F ont une longueur de 214 pm, avec quatre autres atomes de fluor à 272 pm[4]. La géométrie de coordination des atomes de mercure est ainsi un octaèdre déformé. Le composé est souvent écrit sous la forme Hg22+2F−[5].
| Fluorure de mercure(I) | |||
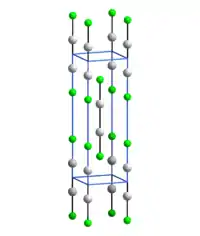
| |||
| Maille cristalline du fluorure de mercure(I) __ Hg+ __ F− |
|||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No ECHA | 100.034.302 | ||
| No CE | 237-747-9 | ||
| PubChem | 4084556 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | F2Hg2 |
||
| Masse molaire[1] | 439,18 ± 0,04 g/mol F 8,65 %, Hg 91,35 %, |
||
| Propriétés physiques | |||
| T° fusion | 570 °C[2] | ||
| Masse volumique | 8,73 g·cm-3[2] | ||
| Précautions | |||
| SGH[2] | |||
   Danger |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Le fluorure de mercure(I) est préparé à partir de carbonate de mercure(I) Hg2CO3 et d'acide fluorhydrique HF :
En présence d'eau, le fluorure de mercure(I) s'hydrolyse en mercure métallique, oxyde de mercure(II) HgO et acide fluorhydrique HF(aq)[3] :
Le fluorure de mercure(I) peut être utilisé pour convertir un halogénure d'alkyle en fluorure d'alkyle[6] :
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Mercury(I) fluoride, 97+% », sur Alfa Aesar (consulté le ).
- (en) Dale L. Perry et Sidney L. Phillips, Handbook of Inorganic Compounds, CRC Press, 1995, p. 256. (ISBN 0-8493-8671-3)
- (en) A. F. Wells, Structural Inorganic Chemistry, Oxford Science Publications, 5e édition, 1984. (ISBN 0-19-855370-6)
- (en) F. Albert Cotton, Geoffrey Wilkinson, Carlos A. Murillo et Manfred Bochmann, Advanced Inorganic Chemistry, Wiley-Interscience, 6e édition, New York, 1999. (ISBN 0-471-19957-5)
- (en) Hans Beyer, Wolfgang Walter et Douglas Lloyd, Organic Chemistry, Horwood Publishing, 1997, p. 136. (ISBN 1-898563-37-3)
