Disulfirame
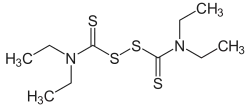
Le disulfirame (nom de marque Espéral) ou bis(diéthylthiocarbamyl)disulfure ou disulfure de tétraéthyl-thiocarbamoyle a pour formule brute C10H20N2S4. C'est une poudre blanche, inodore et de saveur légèrement amère, fondant vers 71 °C. Le disulfirame est très soluble dans l'alcool et dans le chloroforme.
| Disulfirame | |
| |
| Identification | |
|---|---|
| Synonymes |
Disulfure de tétraéthylthiurame |
| No CAS | |
| No ECHA | 100.002.371 |
| No CE | 202-607-8 |
| Code ATC | N07, P03 |
| SMILES | |
| InChI | |
| Apparence | poudre blanche à grise, d'odeur caractéristique[1]. |
| Propriétés chimiques | |
| Formule | C10H20N2S4 [Isomères] |
| Masse molaire[2] | 296,539 ± 0,03 g/mol C 40,5 %, H 6,8 %, N 9,45 %, S 43,25 %, |
| Propriétés physiques | |
| T° fusion | 71 °C[1] |
| T° ébullition | à 2,3 kPa : 117 °C[1] |
| Solubilité | dans l'eau : 0,2 g·L-1[1], très soluble dans l'alcool et dans le chloroforme |
| Masse volumique | 1,3 g·cm-3[1] |
| Précautions | |
| SGH[3] | |
   Attention |
|
| SIMDUT[4] | |
 D2B, |
|
| Classification du CIRC | |
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[5] | |
| Écotoxicologie | |
| LogP | 3,9[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
Il est employé comme médicament dans le cas de dépendance à l'alcool car il inhibe une enzyme nécessaire à l'élimination de l'alcool, l'aldéhyde déshydrogénase, chargée de transformer l'acétaldéhyde en acide acétique. Des études cliniques, initiées en 2009, portent sur l'utilisation du disulfirame et son action sur la dopamine pour lutter contre la dépendance à la cocaïne. Un excès de dopamine augmente l'angoisse, engendre l'augmentation de la pression sanguine et des malaises. Par ailleurs, comme il contient du soufre, il donne mauvaise haleine.
Interaction avec l'alcool
Dans le métabolisme normal, l'alcool éthylique est détruit par le foie par l'action d'une enzyme qui le transforme en acétaldéhyde, lui-même converti par l'aldéhyde déshydrogénase en acide acétique, non dangereux. Ce second processus est bloqué par le disulfirame. Lorsque de l'alcool est absorbé après avoir pris du disulfirame, la concentration d'acétaldéhyde dans le sang peut être 5 à 10 fois plus élevée que lors de la prise de la même quantité d'alcool seule. Comme l'acétaldéhyde est un des principaux facteurs de la gueule de bois, sa présence en forte quantité engendre une réaction dissuasive contre la prise d'alcool. Le disulfirame agit 5 à 10 minutes après l'ingestion d'alcool et le malade ressent les effets de la gueule de bois pendant un laps de temps allant de 30 minutes à plusieurs heures.
Les autres symptômes observés sont le rougissement de la peau, l'accélération du rythme cardiaque, une difficulté à respirer accompagnée de nausées et vomissements. Selon la quantité d'alcool ingérée, l'interaction disulfirame-alcool peut être plus ou moins violente. Plus la quantité d'alcool consommée sous traitement par disulfirame est importante, et plus les symptômes seront forts en intensité. La réaction peut aller jusqu'au collapsus cardio-vasculaire voire jusqu'au coma. L'acétaldéhyde accumulé, responsable de ces symptômes, a un effet vasodilatateur, le sujet peut donc ressentir des gonflements, rougeur, la tension artérielle chute brutalement, et le cœur accélère son rythme en compensation.
On ne doit pas prendre de disulfirame en cas de consommation d'alcool dans les douze dernières heures. Plus la dose de disulfirame est importante, plus son effet est de longue durée. Comme son absorption dans le corps est lente, son élimination prend du temps et son effet peut se faire ressentir deux semaines après l'ingestion du médicament. C'est pourquoi il faut informer en détail le malade des effets de la réaction du disulfirame sur l'alcool.
Le disulfirame est disponible en comprimés de 200, 250 et 500 mg. La dose de départ habituelle est de 500 mg, suivie d'une dose de 250 mg par jour, qui ne devrait pas dépasser 500 mg.
Histoire
L'action du médicament a été découverte par hasard en 1948 par les chercheurs Erik Jacobsen et Jens Hald dans le laboratoire pharmaceutique Medicinalco au Danemark. Au départ, le médicament était destiné à lutter contre des infections parasitaires, mais les chercheurs, qui testèrent eux-mêmes le produit, ressentirent des troubles sérieux après une ingestion d'alcool.
On l'obtient actuellement par condensation de la diéthylamine et du disulfure de carbone en présence de soude. Après cette phase, on effectue une oxydation du diéthyl-dithiocarbamate de sodium obtenu par le persulfate d'ammonium.
Limites
Le disulfirame ne doit pas être considéré comme une guérison de l'alcoolisme car il est plus facile pour un malade de supprimer le disulfirame que l'alcool. Il peut abandonner le traitement s'il n'est pas supervisé. Même si la thérapie d'accompagnement est renforcée, les effets dissuasifs engendrés par le disulfirame risquent de s'avérer insuffisants en cas d'alcoolisme chronique. Le traitement s'adresse plus particulièrement à des malades sélectionnés et motivés, volontaires pour se passer d'alcool lors de séances de psychothérapie de groupe ou individuelles.
La prescription du disulfirame doit être contre-indiquée chez les patients coronariens ou traités par anti-hypertenseurs.
Voir aussi
- Effet Antabuse
- Coprine
Liens externes
- Compendium suisse des médicaments : spécialités contenant Disulfirame
- Effets indésirables
- Disulfiram (patient information)
- Toxicity, Mushroom - Disulfiramlike Toxins
Notes et références
- DISULFIRAME, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Disulfiram » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme », sur http://monographs.iarc.fr, CIRC, (consulté le )