Dioxygénase
Les dioxygénases sont des enzymes ayant une activité d'oxydoréductase. Elles oxydent une ou plusieurs molécules de substrat par du dioxygène O2 sans libérer de molécule d'eau H2O, à la différence des monooxygénases. Ces enzymes mettent en œuvre une grande variété de mécanismes réactionnels et de cofacteurs, ces derniers contenant du fer sous différentes formes.
Dioxygénases à fer
Dioxygénases à fer mononucléaire
Les dioxygénases à fer mononucléaire, également appelées dioxygénases à fer non héminique, utilisent un cation de fer unique pour incorporer à un substrat un ou deux atomes d'oxygène d'une molécule de dioxygène O2. Elles mettent en œuvre divers modes d'activation de l'oxygène pour amorcer ces réactions[2]. Par exemple, le clivage d'une liaison carbone-carbone ou d'une liaison carbone-soufre, l'hydroperoxydation d'un acide gras et l'oxydation d'un thiol sont des réactions catalysées par des dioxygénases à fer mononucléaire[2] - [3] - [4].
La plupart des dioxygénases à fer mononucléaire appartiennent à la superfamille des cupines (en), dans lesquelles la structure du domaine est décrite comme un tonneau β à six feuillets au centre duquel se trouve un cation métallique, le plus souvent de fer, coordonné à des résidus situés dans deux motifs partiellement conservés, notés G(X)5HXH(X)3-4E(X)6G et G(X)5-7PXG(X)2H(X)3N[5] - [6]. Les catéchol dioxygénases (en) et les hydroxylases alpha-cétoglutarate-dépendantes (en) sont des exemples de dioxygénases à fer mononucléaire[7].
Dioxygénases de Rieske
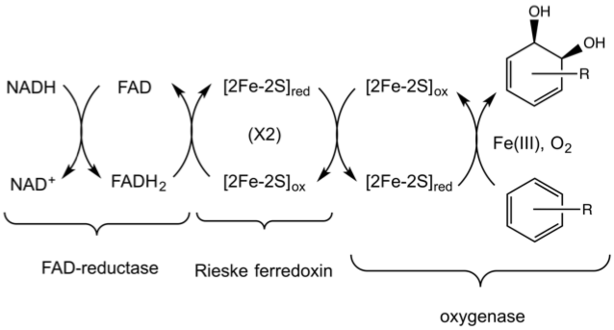
Les dioxygénases de Rieske catalysent la cis-dihydroxylation d'arènes en cis-dihydro-diols. Ces enzymes sont présentes avant tout chez les bactéries du sol, telles que celles du genre Pseudomonas[4], et catalysent souvent l'étape initiale de la biodégradation des hydrocarbures aromatiques[3]. Elles sont structurellement plus complexes que les autres dioxygénases afin de permettre un double transfert d'électrons pour réduire le substrat aromatique.
Une dioxygénase de Rieske fonctionnelle est constituée de trois éléments : une FAD réductase NADH-dépendante (en), une ferrédoxine avec deux centres fer-soufre [2Fe-2S] de type Rieske, et une oxygénase α3β3 dont chaque sous-unité α contient un cation de fer mononucléaire et un centre [2Fe-2S][3]. Ces deux structures sont éloignées d'environ 43 Å dans chacune des sous-unités α, distance bien trop grande pour permettre un transfert d'électrons efficace, de sorte qu'on pense que le transfert d'électrons intervient entre sous-unités adjacentes, dans la mesure où le centre [2Fe-2S] d'une sous-unité α n'est éloigné que de 12 Å environ du centre de fer mononucléaire de la sous-unité α voisine. Le remplacement du résidu d'aspartate pontant fait disparaître l'activité enzymatique, ce qui suggère que le transfert d'électrons intervient le long du réseau de liaisons hydrogène maintenu par ce résidu[4].
![Structure du site actif d'une dioxygénase de Rieske indiquant le centre fer-soufre [2Fe-2S] à gauche, le fer monocaténaire à droite, et le résidu d'aspartate pontant en bas (PDB 2B1X).](https://img.franco.wiki/i/2B1X_Active_Site.png.webp) Structure du site actif d'une dioxygénase de Rieske indiquant le centre fer-soufre [2Fe-2S] à gauche, le fer monocaténaire à droite, et le résidu d'aspartate pontant en bas (PDB 2B1X).
Structure du site actif d'une dioxygénase de Rieske indiquant le centre fer-soufre [2Fe-2S] à gauche, le fer monocaténaire à droite, et le résidu d'aspartate pontant en bas (PDB 2B1X).
Le mécanisme réactionnel de cette classe de dioxygénases n'est pas encore très clair, mais des éléments indiquent qu'il se forme un hydroperoxyde de fer(III) intermédiaire[8]. Ces enzymes sont des oxydoréductases puissantes qui, outre la dioxygénation, peuvent également intervenir dans des réactions de sulfoxydation, de désaturation et d'oxydation benzylique.
Dioxygénase à fer héminique
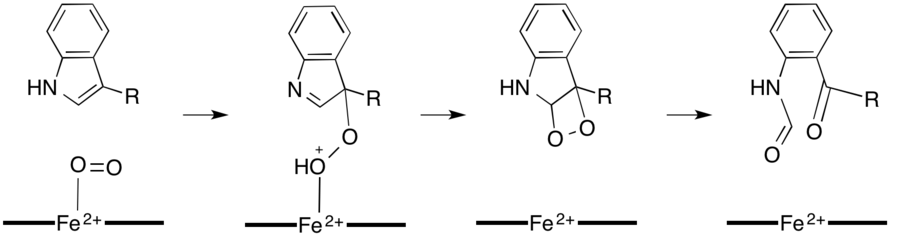
Certaines dioxygénases comme la tryptophane 2,3-dioxygénase (en) (TDO) et l'indoleamine 2,3-dioxygénase (IDO), qui catalysent l'oxydation du tryptophane en N'-formylkynurénine, utilisent un cation de fer coordonné dans un groupe prosthétique de type hème b[9] - [10]. Ces enzymes jouent un rôle important dans la régulation du tryptophane dans les cellules, ce qui a diverses implications physiologiques[11]. L'interaction entre le dioxygène O2 et le fer dans le site actif de l'enzyme fait probablement intervenir une addition radicalaire ou une addition électrophile sur du fer respectivement ferreux Fe2+ ou ferrique Fe3+[9]. On pense que ces réactions mettent en œuvre un réarrangement de Criegee ou passent par un dioxétane[9] - [11].
Dioxygénases cambialistiques
Si le fer est de loin le cofacteur le plus fréquent des dioxygénases, d'autres cofacteurs peuvent également être utilisés. Par exemple, la quercétine 2,3-dioxygénase (en), qui catalyse le clivage par dioxygénation de la quercétine en acide 2-protocatéchuoyl-phloroglucinol-carboxylique et monoxyde de carbone[12]. La mieux caractérisée de ces enzymes, celle d'Aspergillus violaceofuscus (en), fonctionne en présence de cuivre[5], tandis qu'on a découvert des quercétinases bactériennes particulièrement cambialistiques[13], présentant divers degrés d'activité enzymatique en présence de cations divalents de manganèse Mn2+, de cobalt Co2+, de fer Fe2+, de nickel Ni2+ et de cuivre Cu2+[12]. L'aciréductone dioxygénase fer(II)-dépendante (en) (ARD) est présente à la fois chez les procaryotes et les eucaryotes[5] - [12] - [14] ; les ARD de la plupart des espèces se lient au fer ferreux et catalysent l'oxydation de la 1,2-dihydroxy-5-(méthylthio)pent-1-én-3-one en formiate et 4-(méthylthio)-2-oxobutanoate, ce dernier étant l'α-cétoacide de la méthionine. L'ARD de Klebsiella oxytoca catalyse une autre réaction lorsqu'elle est liée au nicket Ni2+, produisant du monoxyde de carbone, du formiate et du 3-(méthylthio)propionate à partir d'aciréductone et de dioxygène.
La Fe-ARD est étroitement liée à la voie de sauvetage de la méthionine, dans laquelle la méthylthioadénosine produite à partir de la S-adénosylméthionine cellulaire est finalement convertie en aciréductone. Le rôle de la Ni-ARD est moins bien compris, mais on pense qu'elle aide à réguler le taux de méthionine en agissant comme une déviation de la voie de sauvetage. L'enzyme de Klebsiella oxytoca est l'un des seuls exemples où la nature du cation métallique détermine la réaction catalysée. Les quercétinases et les ARD appartiennent à la superfamille des cupines (en), qui contient également les enzymes à fer mononucléaire[15].
La capacité qu'ont ces dioxygénases à conserver une activité enzymatique en présence de divers cofacteurs métalliques présentant des potentiels d'oxydoréduction variables suggèrent que le centre métallique ne joue pas un rôle actif dans l'activation du dioxygène mais qu'il intervient plutôt dans la configuration du substrat par rapport à ce dernier, ce qui rappelle le fonctionnement des intradiol catéchol dioxygénases (en).
Notes et références
- (en) Matthew W. Vetting, David A. D'Argenio, L. Nicholas Ornston et Douglas H. Ohlendorf, « Structure of Acinetobacter Strain ADP1 Protocatechuate 3,4-Dioxygenase at 2.2 Å Resolution: Implications for the Mechanism of an Intradiol Dioxygenase », Biochemistry, vol. 39, no 27, , p. 7943-7955 (PMID 10891075, DOI 10.1021/bi000151e, lire en ligne)
- (en) Stefan Leitgeb et Bernd Nidetzky, « Structural and functional comparison of 2-His- 1-carboxylate and 3-His metallocentres in non-haem iron(II)-dependent enzymes », Biochemical Society Transactions, vol. 38, no 6, , p. 1180-1186 (PMID 19021520, DOI 10.1042/BST0361180)
- (en) Mahdi M. Abu-Omar, Aristobulo Loaiza et Nikos Hontzeas, « Reaction Mechanisms of Mononuclear Non-Heme Iron Oxygenases », Chemical Reviews, vol. 105, no 6, , p. 2227-2252 (PMID 15941213, DOI 10.1021/cr040653o, lire en ligne)
- (en) Samuel de Visser et Devesh Kumar, Iron-containing enzymes versatile catalysts of hydroxylation reactions in nature, Royal Society of Chemistry, 2011. (ISBN 978-1-84973-298-7)
- (en) Susanne Fetzner, « Ring-Cleaving Dioxygenases with a Cupin Fold », Applied and Environmental Microbiology, vol. 78, no 8, , p. 2505-2514 (PMID 22287012, PMCID 3318818, DOI 10.1128/AEM.07651-11, lire en ligne)
- (en) Martha H. Stipanuk, Chad R. Simmons, P. Andrew Karplus et John E. Dominy Jr., « Thiol dioxygenases: unique families of cupin proteins », Amino Acids, vol. 41, no 1, , p. 91-102 (PMID 20195658, PMCID 3136866, DOI 10.1007/s00726-010-0518-2, lire en ligne)
- (en) Edward I. Solomon, Thomas C. Brunold, Mindy I. Davis, Jyllian N. Kemsley, Sang-Kyu Lee, Nicolai Lehnert, Frank Neese, Andrew J. Skulan, Yi-Shan Yang et Jing Zhou, « Geometric and Electronic Structure/Function Correlations in Non-Heme Iron Enzymes », Chemical Reviews, vol. 100, no 1, , p. 235-350 (PMID 11749238, DOI 10.1021/cr9900275, lire en ligne)
- (en) Timothy D. H. Bugg et S. Ramaswamy, « Non-heme Iron-Dependent Dioxygenases: Unravelling Catalytic Mechanisms for Complex Enzymatic Oxidations », Current Opinion in Chemical Biology, vol. 12, no 2, , p. 134-140 (PMID 18249197, DOI 10.1016/j.cbpa.2007.12.007)
- (en) Igor Efimov, Jaswir Basran, Sarah J. Thackray, Sandeep Handa, Christopher G. Mowat et Emma Lloyd Raven, « Structure and Reaction Mechanism in the Heme Dioxygenases », Biochemistry, vol. 50, no 14, , p. 2717-2724 (PMID 21361337, PMCID 3092302, DOI 10.1021/bi101732n, lire en ligne)
- (en) Masanori Sono, Mark P. Roach, Eric D. Coulter et John H. Dawson, « Heme-Containing Oxygenases », Chemical Reviews, vol. 96, no 7, , p. 2841-2888 (PMID 11848843, DOI 10.1021/cr9500500, lire en ligne)
- (en) Sarah J. Thackray, Christopher G. Mowat et Stephen K. Chapman, « Exploring the mechanism of tryptophan 2,3-dioxygenase », Biochemical Society Transactions, vol. 36, no 6, , p. 1120-1123 (PMID 19021508, PMCID 2652831, DOI 10.1042/BST0361120, lire en ligne)
- (en) Matthew R. Schaab, Brett M. Barney et Wilson A. Francisco, « Kinetic and Spectroscopic Studies on the Quercetin 2,3-Dioxygenase from Bacillus subtilis », Biochemistry, vol. 45, no 3, , p. 1009-1016 (PMID 16411777, DOI 10.1021/bi051571c, lire en ligne)
- (en) Leandro C. Tabares, Cristian Bittel, Néstor Carrillo, Ana Bortolotti et Néstor Cortez, « The Single Superoxide Dismutase of Rhodobacter capsulatus Is a Cambialistic, Manganese-Containing Enzyme », Journal of Bacteriology, vol. 185, no 10, , p. 3223-3227 (PMID 12730184, PMCID 154076, DOI 10.1128/JB.185.10.3223-3227.2003, lire en ligne)
- (en) Michael J. Maroney et Stefano Ciurli, « Nonredox Nickel Enzymes », Chemical Reviews, vol. 114, no 8, , p. 4206-4228 (PMID 24369791, PMCID 5675112, DOI 10.1021/cr4004488, lire en ligne)
- (en) Jodi L. Boer, Scott B. Mulrooney et Robert P. Hausinger, « Nickel-Dependent Metalloenzymes », Archives of Biochemistry and Biophysics, vol. 544, , p. 142-152 (PMID 24036122, PMCID 3946514, DOI 10.1016/j.abb.2013.09.002)