Addition radicalaire
Une addition radicalaire est un type de réaction d'addition en chimie organique impliquant un radical[1]. Cette addition peut avoir lieu entre un radical et un non-radical, ou entre deux radicaux.
Mécanisme
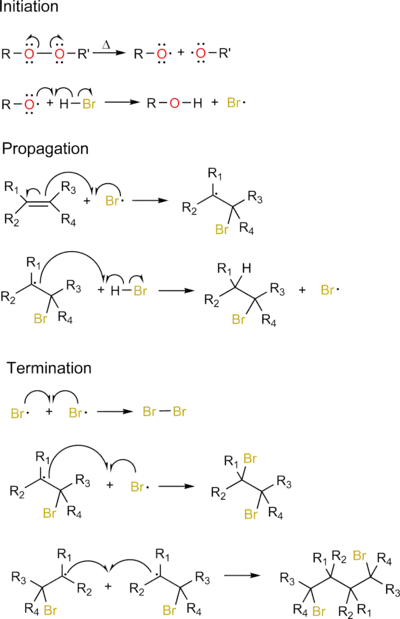
La plupart des réactions d'addition radicalaire se font selon un mécanisme de réaction en chaîne :
- amorçage (initiation en anglais) : création de radicaux, à partir d'un précurseur non radicalaire. Celui-ci peut s'effectuer de deux façons :
- soit à partir d'une espèce qui spontanément forme des radicaux (typiquement un peroxyde). En ce cas, une étape de transfert supplémentaire est nécessaire pour créer le radical réactif dont on a besoin (R-O. + H-Br → R-OH + Br. par exemple),
- soit à partir de l'espèce qu'on souhaite faire réagir et qu'on transforme en radical par voie photochimique (irradiation UV en règle générale) ;
- propagation : le radical réagit avec un composé non radicalaire pour former une nouvelle espèce radicalaire ;
- terminaison : deux radicaux réagissent ensemble pour créer une espèce non radicalaire.
Addition radicalaire du bromure d'hydrogène sur un alcène
Un exemple type d'addition radicalaire est l'addition radicalaire du bromure d'hydrogène (H-Br) sur un alcène, produisant un bromoalcane. Pour démarrer le processus radicalaire, on ajoute aux réactifs une quantité catalytique de peroxyde organique, afin d'empêcher une addition électrophile classique, et générer un radical brome à partir de HBr.
Contrairement à une addition électrophile « classique », ce n'est pas le produit le plus substitué (règle de Markovnikov) qui est obtenu majoritairement, mais l'autre ; on parle d'orientation anti-Markovnikov ou d'effet Kharasch. Cela est dû au mécanisme réactionnel :
- dans une addition électrophile classique de H-Br, l'étape-clé pour l'orientation du produit final est l'attaque électrophile sur l'alcène, produisant un carbocation. Celui-ci devant être stabilisé pour produire la réaction, il se formera sur le carbone le plus substitué, où ira ensuite s'additionner l'ion halogénure ;
- ici, l'étape-clé est l'addition radicalaire de Br• sur l'alcène. Il se forme alors un carboradical, qui pour être stabilisé et permettre à la réaction de se poursuivre doit se former sur le carbone le plus substitué. Le radical Br• va donc s'additionner sur le carbone le moins substitué.
Ce type de réaction ne se produit pas avec HCl ou HI, car les deux réactions sont extrêmement endothermiques et donc chimiquement défavorables.
Cyclisations radicalaires oxydatives auto-terminantes
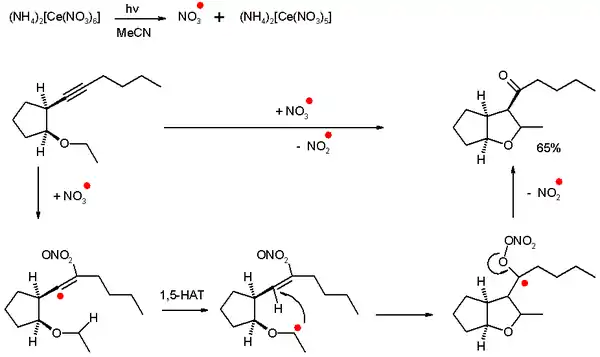
Dans un certain type d'additions radicalaires, appelées cyclisations radicalaires oxydatives auto-terminantes, les alcynes sont oxydés en cétones par une cyclisation radicalaire intramoléculaire, et les expèces radicalaires sont inorganiques et non basées sur des composés carbonés. Ce type de réaction est auto-terminante car la propagation n'est plus possible et l'amorceur utilisé en quantité stœchiométrique[2].
Par exemple, un radical nitrate généré par photolyse du nitrate de cérium et d'ammonium (CAN) peut réagir avec un alcyne pour générer un radical vinyle très réactif, et va former, via un transfert-1,5 d'atome d'hydrogène (HAT) et une fermeture de cycle 5-exo-trig, un radical cétyle. Le composé va alors éliminer un radical nitrate pas assez réactif pour une propagation, et former une cétone.
L'espèce radicalaire effectivement présente ici est le synthon d'un unique atome d'oxygène. D'autres radicaux inorganiques présentent le même type de réactivité, comme les ions radicaux sulfate (formés à partir de persulfate d'ammonium) ou les radicaux hydroxyles.
Autres types de réactions radicalaires
Notes et références
- (en) L.G. Wade's, Organic Chemistry, 5e éd., p. 319, Mechanism supplements original
- (en) [PDF] Tim Dreessen, Christian Jargstorff, Lars Lietzau, Christian Plath, Arne Stademann et Uta Wille, Self-Terminating, Oxidative Radical Cyclizations, Molecules 2004, 9, 480–497 lire en ligne
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Free-radical addition » (voir la liste des auteurs).